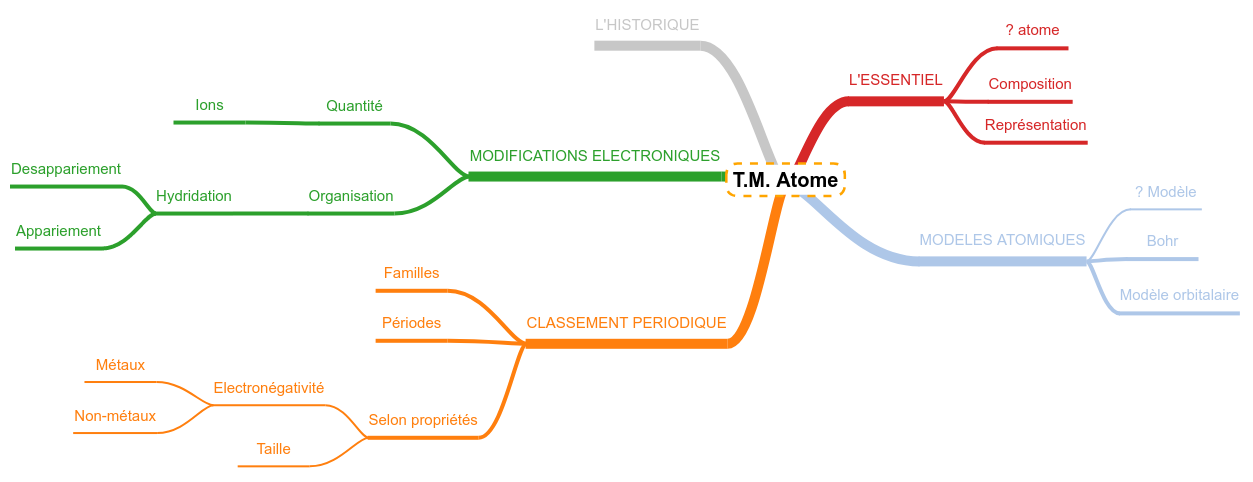
Tout savoir sur ... les atomes
|
un memory sur le nom des éléments les plus utilisés
sur les concepts théoriques importants
|
Dans chaque type de jeux, différents plateaux sont disponibles et proposés de façon aléatoire. Vous pouvez donc vous exercer à plusieurs reprises sur chaque jeu.
|
Si après avoir travaillé la matière avec les outils du site, vous avez encore des questions ou besoin d'un coaching méthode, vous pouvez nous contacter. Notre équipe didactique se fera un plaisir de vous aider.
|
|
Qu'est-ce qu'un atome | ||||
|
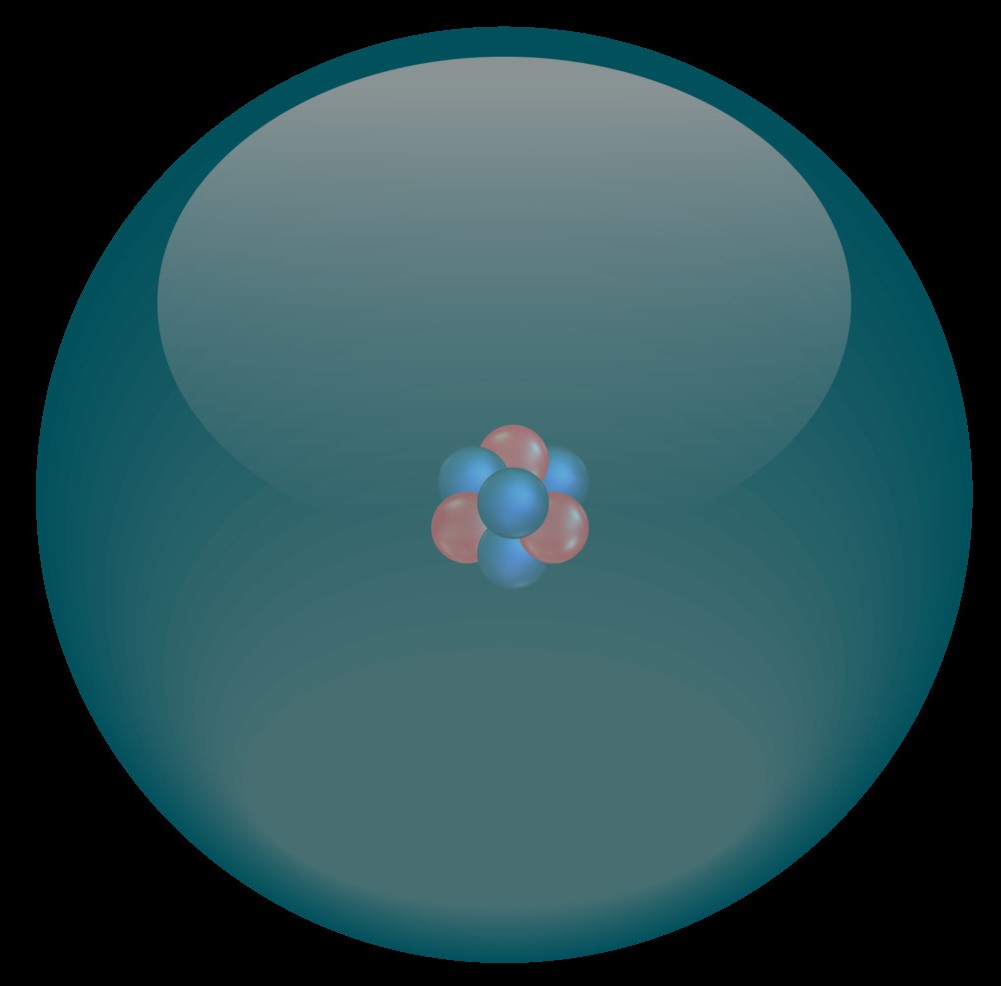
Un atome est la plus petite particule d'une matière qui possède les propriétés de cette matière. Les atomes sont en quelque sorte les briques de base de la chimie avec lesquels nous allons pouvoir, en temps que chimistes, construire toutes les matières qui nous entourent.
|
|
Un atome est composé de deux zones différentes :
Constitué de nucléons que sont les protons (chargés positivement) et les neutrons (neutres). Il représente un bloc dense et la grande majorité de la masse de l'atome. Protons et neutrons ont environ la même masse.
Constitué d'électrons qui se déplacent très vite autour du noyau. Ils sont chargés négativement et sont environ 2000 fois plus légers que les nucléons. Afin que l'atome soit neutre, il y a dans un atome autant d'électrons que de protons. La masse d'un atome (notée A) est donc la somme des masses des protons et des neutrons qui le composent. |
On classe les atomes en fonction de leur nombre de protons. Le plus petit atome contient 1 proton et un électron (il s'agit de l'atome dhydrogène). On, lui attribue le numéro atomique (noté Z) égal à 1. A chaque fois que l'on ajoute un proton, on aura un nouveau type d'atome, on augmentera chaque fois son numéro atomique.
|
|
Comment représente-t-on un atome ? |
||||
Le dessin n'est pas une bonne représentation de l'atome. Elle s'avère vite compliquée et longue. On va utiliser le concept d'élément pour caractériser un type d'atome. On attribuera un symbole à chaque élément.
|
L'ELEMENT est un type d'atome caractérisé par un symbole chimique et un numéro atomique. Ils sont classés dans le tableau périodique des éléments : chaque case contient un élément.
A chaque case, on ajoute un proton (et donc un électron pour conserver la neutralité des atomes). Les éléments sont donc caractérisés par un nombre de protons unique (et d'électrons donc). |
Par contre, on peut avoir pour un même élément, des atomes contenant un nombre de neutrons différents, on appellera chaque "sous-élément" un NUCLEIDE. Un nucléide, est lui défini par son symbole, son numéro atomique et par sa masse atomique.
On dira que chaque nucléide d'un élément est isotope des autres nucléides du même élément (c'est une relation entre eux, comme être le frère de ... ou la soeur de .... ).
Un nucléide est caractérisé à la fois par :
|
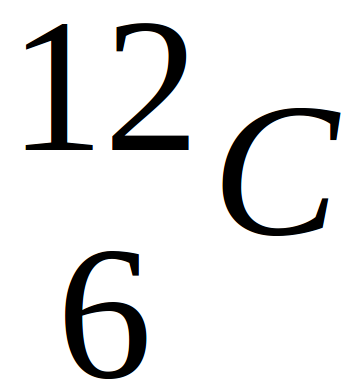 |
A l 'aide de ces deux données (numéro et masse), il est donc facile d'en déterminer la composition en protons, neutrons et électrons.
L'élement carbone possède 3 isotopes : le carbone 12, le carbone 13 et le carbone 14. Comme ce sont tous des nucléides du carbone, ils ont tous :
- 6 protons
- 6 électrons
Leur différence de masse provient de leur composition différente en neutrons, respectivement 6, 7 et 8.
 |
 |
 |
 |
 |
| 3 nucléides | 1 élément | |||
Dans le tableau périodique, ils sont tous les 3 rassemblés en une seule case, appelée "carbone", c'est l'élément. La masse attribuée à cet élément est appelée masse atomique.
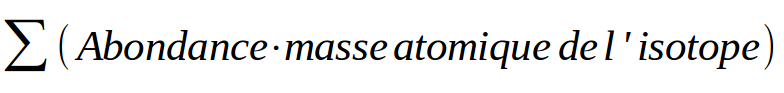
Pourquoi fonctionner ainsi ? Simplement parce que si je prend x grammes d'un élément, je vais très certainement retrouver les différents isotopes qui existent dans la nature en quantité globalement similaire à leur abondance.
Cette valeur représente la masse atomique. Elle est exprimée en Unité de Masse Atomique (U.M.A). L'U.M.A représente le douzième de la masse du nucléide 12C.
Pour qu'elle soit RELATIVE il faut la diviser par 1 U.M.A de telle façon à ce que la masse atomique relative n'ait pas d'unités !
 |
Cette formule permet aussi de calculer les paramètres isotopiques, si on connait la masse atomique relative. C'est une variante d'exerice. En vous fournissant la masse atomique relative et toutes les informations sur les isotopes sauf une, vous pouvez facilement retrouver la donnée manquante. |
 |
Dans les cases du tableau périodique, on indique souvent le numéro atomique en haut de la case et la masse en bas de la case ... Dans la notation d'un nucléide, c'est le contraire ... La masse est au dessus et le numéro atomique en dessous. C'est ainsi ... Autant le savoir pour ne pas se tromper ! |
 |
Qu'est-ce qu'un modèle ? |
||||
L'atome est tellement petit (de l'ordre de l'angström (10-10 m) qu'il est impossible, comme beaucoup d'objet de le voir ... On ne peut donc pas l'observer directement pour le décrire. Il nous faut passer par ce que l'on appelle des observations indirectes.
Observer indirectement, c'est réaliser des expériences dont les résultats nous en apprennent plus sur la structure du corps étudié. Cela veut dire aussi qu'il s'agit de faire des hypothèses et de les vérifier.
Ces vérifications mènent à l'élaboration d'un modèle. Il ne s'agit ni d'un schéma, ni d'une photographie mais plutôt d'une idée de l'objet que l'on affine peu à peu. Un modèle n'est donc probablement pas la réalité.
Il permet en tout cas de conceptualiser, de matérialiser cet objet avec le plus d'exactitude possible. Chaque découverte affine un peu plus cette image que l'on en a. A tout moment, on confronte le modèle à ce que l'on voit (structure de molécules, ...) et on ajoute une couche (un concept) pour l'aider à expliquer ce que l'on voit ...
| Un modèle, c'est comme un oignon, on a le noyau central qui fait l'image globale et on a différentes couches qui sont venue s'ajouter pour tenter d'expliquer un peu mieux la réalité. |  |
|
|
La conception atomique de Bohr : la base essentielle |
||||
|
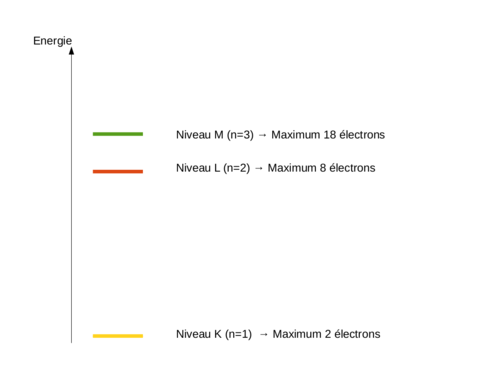
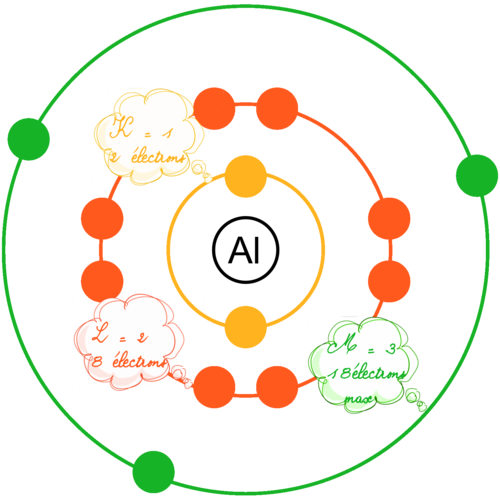
En 1913, Niels Bohr, se basant sur les modèles atomiques précédents et sur ses travaux fait évoluer les modèles de l'époque vers un modèle que nous utilisons toujours aujourd'hui pour décrire basiquement l'atome. On sait actuellement qu'il est faux ... mais son grand avantage est d'être simple à comprendre et à utiliser et assez proche de la réalité comme première description de l'atome. Pour lui, l'atome ressemble à un système planétaire où le noyau est au centre et où les électrons gravitent sur des orbites circulaires précises identifiées par des lettres (K,L,M,N,O,P,Q). A chaque lettre correspond à un numéro qui est le numéro de la couche (K=1, L=2, M=3, ....). Il défini pour chaque couche, un nombre d'électrons maximum égal à 2.n² où n est le numéro de la couche. |
 |
La conception orbitalaire : une couche importante du modèle ! | ||||
Le modèle de Bohr a ses limites, il a donc fallu l'améliorer afin de remédier aux problèmes rencontrés. C'est la naissance d'un nouveau modèle appelé modèle orbitalaire qui modifie fondamentalement le déplacement des électrons autour du noyau. Il a pour origine tous les travaux effectués dans le cadre de ce que l'on appelle la "mécanique quantique".
Qu'est-ce que la mécanique quantique ?
La mécanique quantique vient modifier la vision dite classique de la physique, basée sur les lois de Newton. Alors que la mécanique classique permet fort bien d'expliquer les phénomènes macroscopiques (le déplacement d'objets par exemple), elle ne permet pas de rendre compte de phénomènes que subissent les particules très petites telles que les électrons, les protons ou les neutrons.
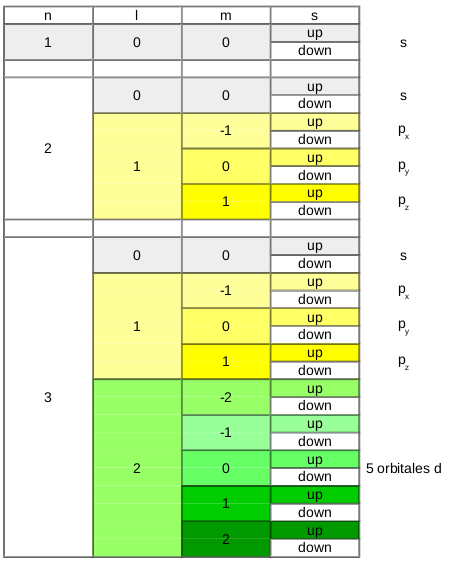
4 nombres quantiques pour définir la structure électronique
La théorie postule l'existance de 4 nombres quantiques. Ceci signifie que leur existence n'a pas été démontrée mais tant que l'on ne peut démontrer leur non existence, on peut présumer qu'ils existent.
Ces 4 nombres sont :
- n : le nombre quantique principal
- l : le nombre quantique secondaire ou azimutal
- m : le nombre quantique magnétique
- s : le nombre quantique de spin
Chaque nombre représente une caractéristique pour l'orbitale ou l'électron. A eux 4, ils permettent d'identifier un électron particulier. La même série des 4 nombres ne peut donc pas être attribuée à deux électrons différents.
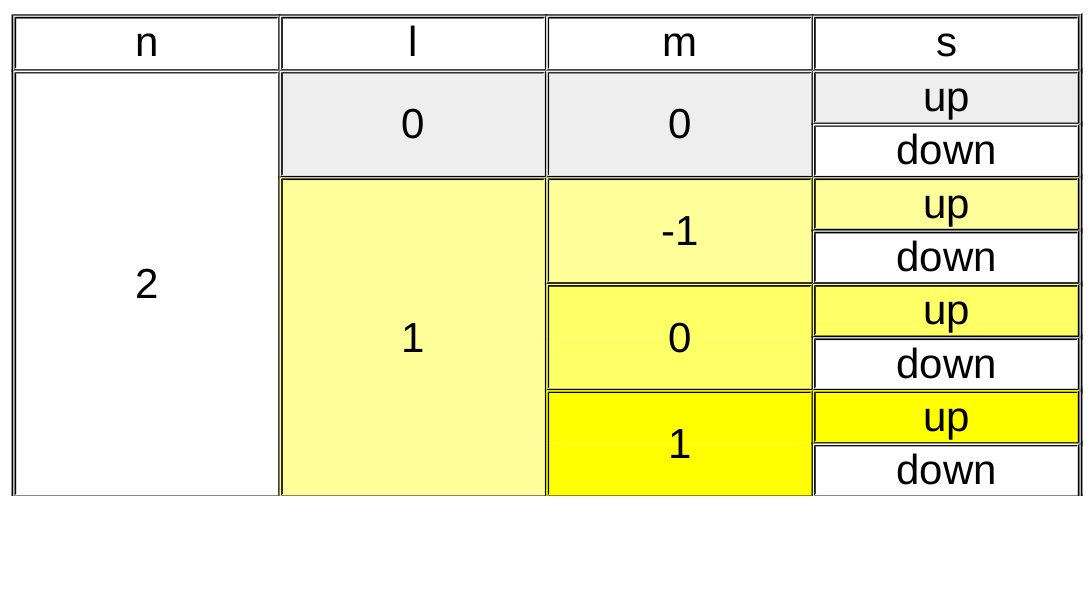
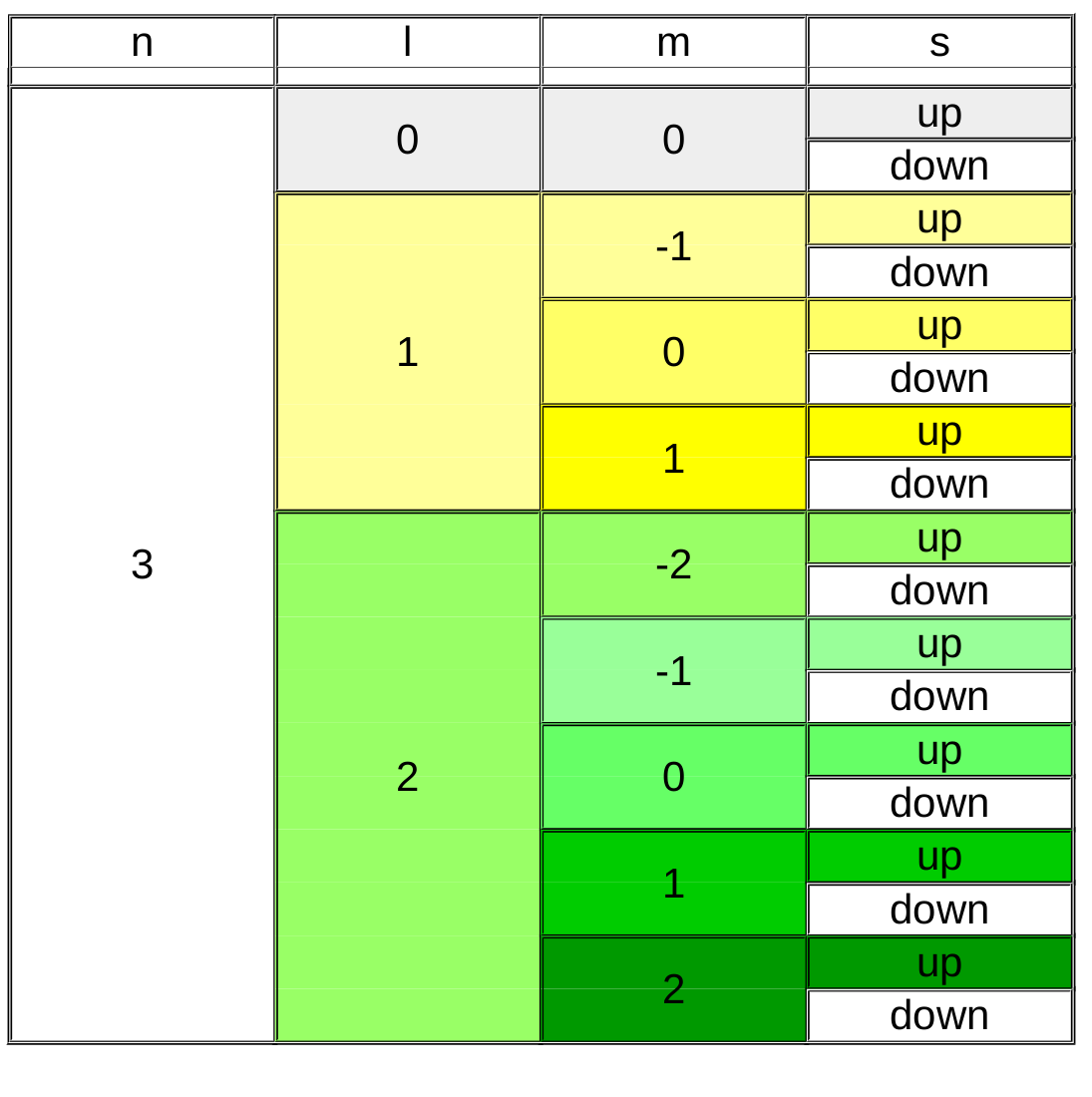
Le nombre quantique principal (n) est de loin le plus facile à comprendre, il désigne la couche électronique et prend des valeurs entières (1,2,3,4,...) ... C'est celui que nous connaissons aussi chez Bohr et qui est présent dans le tableau périodique pour numéroter chaque période.
Le nombre quantique secondaire (l) va donner une forme à l'orbitale. Sa valeur sera liée à la valeur du nombre quantique principal : sa valeur sera comprise entre 0 et n-1.
Le nombre quantique magnétique (m) oriente l'orbitale dans l'espace. Sa valeur sera liée à la valeur du nombre quantique secondaire et sera comprise entre -l et +l.
Finalement, le nombre quantique de spin (s) caractérise la rotation de l'électron sur lui même et ne peut prendre que deux valeurs :
- spin up = +1/2
- spin down = -1/2
Le fait que le spin ne peut prendre que deux valeurs et que les 4 nombres quantiques ne peuvent être identiques pour deux électrons différents impose qu'une orbitale ne peut contenir que deux électrons {Principe de Pauli}.
Un outil simple pour déterminer la structure électronique
Nous sommes loin d'avoir vu toute la théorie orbitalaire. Nous remarquons qu'il y a des particularités dans l'apparition successive des orbitales.
Nous pouvons établir la structure élecronique des éléments en suivant le tableau périodique case par case comme nous l'avons fait plus haut. Mais il existe un moyen mnémotechnique, plus simple, plus rapide pour prévoir la structure électronique des éléments assez fidèlement. L'utiliser nous permettra de déterminer la structure électronique de chaque élément. Attention, il restera quelques particularités dont nous ne parlerons pas ici.
|
Le principe est simple. Il suffit de construire le tableau de gauche puis detracer des flèches diagonales barrant les cases en partant du coin supérieur droit au coin inférieur gauche. La succession des orbitales se construit alors en suivant les flèches les unes après les autres en commençant par le haut. La lecture nous donne : 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s ... |
|
|
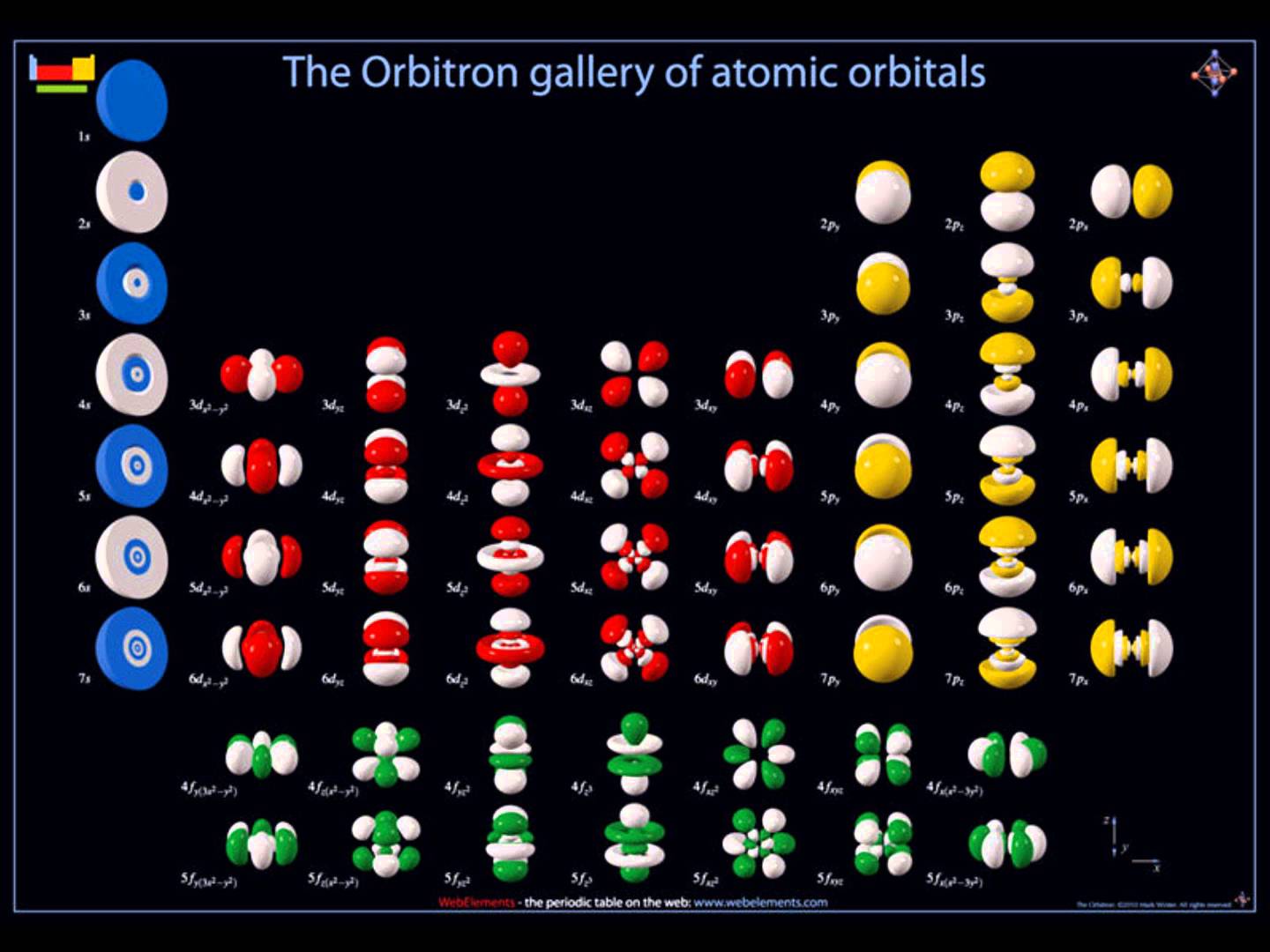
A quoi ressemblent les orbitales ?
Les orbitales sont en réalité des fonctions mathématiques dont les volumes sont déterminés par calcul (calcul ab initio). Afin de ne pas compliquer inutilement notre apprentissage, nous ne chercherons à visualiser que deux types d'orbitales atomiques : les orbitales s et les orbitales p. A chaque couche, les orbitales grandissent.
 |
 |
|
|
|
Les orbitales de type p sont composées de deux lobes orientés dans une direction de l'espace cartésien (x,y et z). Cette représentation est inspirée du travail de Dhatfield — File:P2M0.png, CC BY-SA 3.0. |
|
 |
|
 |
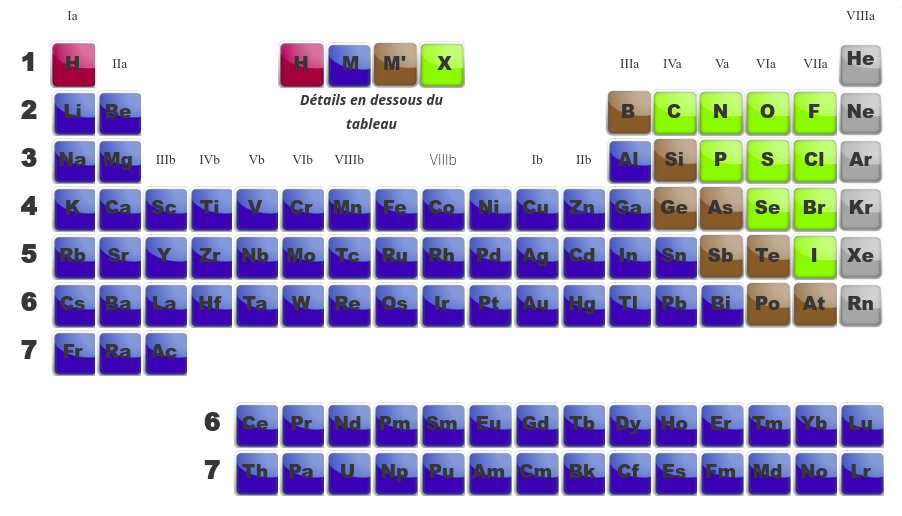
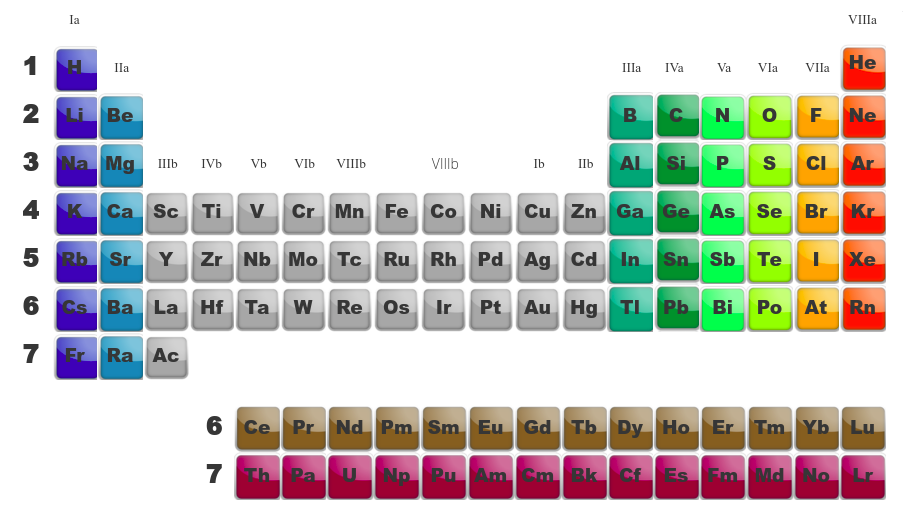
Le tableau périodique contient l'ensemble des éléments existant. Ils y sont classés en périodes (lignes) et en familles (colonnes). Ce classement a été réalisé au fil du temps et initié par Mendeleïev sur base des propriétés physiques et chimiques des éléments. Les périodes permettent le classement par couche électroniques. Dans une meme période, de case en case, on ajoute à chaque fois un proton et donc un électron. Le point commun de tous les éléments d'une même période est qu'ils ont la même couche électronique externe caractérisée par le numéro qui se trouve au début de la période (le nombre quantique principal, n).
 |
Les familles | ||||
Dans une famille, les éléments ont des propriétés similaires. On découvre qu'il y a des familles "a" et des familles "b".
Les familles a sont celles qui sont le plus facile à appréhendre dans leurs propriétés électroniques. Il arrive souvent, qu'au début de l'apprentissage de la chimie, on demande de plier le tableau afin de ne voir que ces familles a.
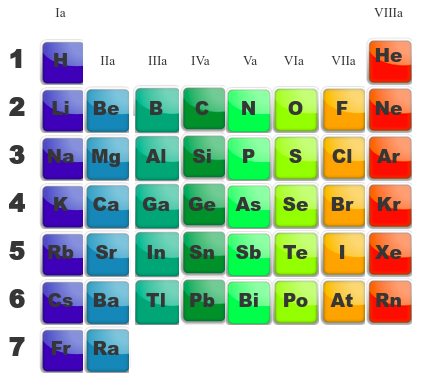 |
La famille Ia s'appelle les ALCALINS La famille IIa s'appelle les ALCALINO-TERREUX La famille IIIa s'appelle les TERREUX La famille IVa s'appele les CARBONIDES La famille Va s'appelle les AZOTIDES La famille VIa s'appelle les SULFURIDES La famille VIIa s'appelle les HALOGENES La dernière famille s'appelle les GAZ NOBLES ou GAZ INERTES |
Chaque famille rassemble des éléments qui ont le même nombre d'électrons périphériques (même nombre d'électrons sur la dernière couche). Ainsi, à chaque famille, on associe une structure appelée "structure de Lewis".
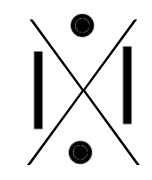
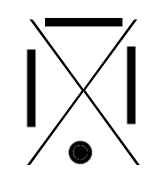
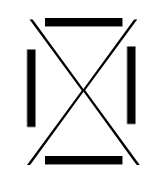
C'est une convention qui permet de représenter visuellement la composition de la dernière couche d'un atome en utilisant :
- un point pour représenter un électron célibataire
- un trait pour représenter un doublet (deux électrons sur une même orbitale).
Voici les différentes structures de lewis, famille après famille :
| Ia | IIa | IIIa | IVa | Va | VIa | VIIa | VIIIa |
| ALCALINS | ALCALINO-TERREUX | TERREUX | CARBONIDES | AZOTIDES | SULFURIDES | HALOGENES | GAZ INERTES |
 |
 |
 |
 |
 |
 |
 |
 |
Les familles b sont appelées "métaux de transition". Ils ont des propriétés particulières.
 |
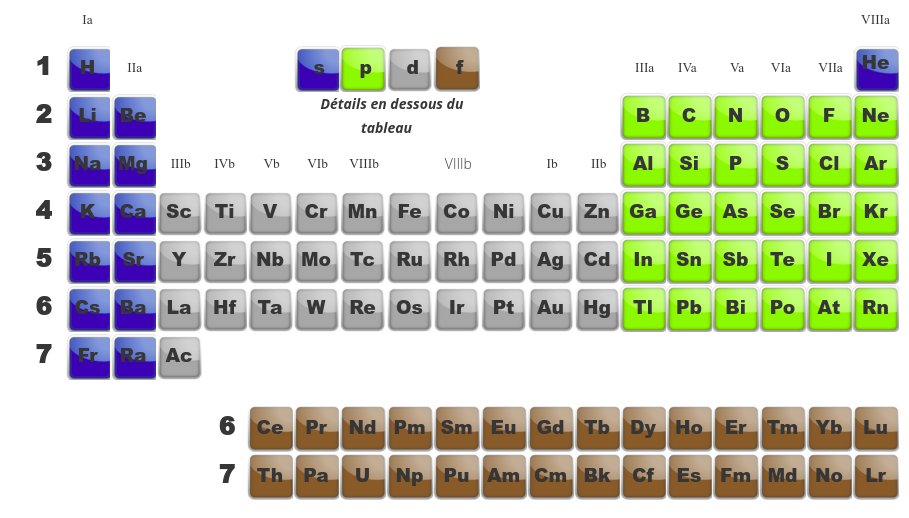 |
Quand on compare les tableau de gauche (montrant les différentes familles) avec celui de droite (montrant la dernière orbitale en cours de remplissage), on se rend compte de similitudes. Ainsi :
-
les deux premières familles (alcalins et alcalino-terreux) ont une orbitale du type s comme dernière orbitale. -
Les métaux de transition, eux, ont comme dernière orbitale, des orbitales de type d. -
Les terreux (famille IIIa), les carbonides (IVa), les azotides (Va), les sulfurides (VIa), les halogènes (VIIa) et les gaz inertes (VIIIa) remplissent des orbitales p. -
Finalement, les actinides et les lanthanides qui sont en dessous du tableau remplissent des orbitales f.
Le classement des éléments dans le tableau périodique est lié à leur composition en protons. Il est donc possible à partir de cette composition de retrouver la position d'un élément.
 |
Les métaux, les non-métaux ... et les autres ! | ||||
On a l'habitude dans le tableau périodique de regrouper les éléments en trois groupes différents ; les métaux, les non-métaux et les métalloïdes. Ce regroupement provient du fait qu'ils ont certaines caractéristiques similaires.
On peut distinguer les métaux des non-métaux chimiquement ou physiquement. Voici un tableau qui reprend ce qui différencie généralement les propriétés des métaux et des non-métaux. On remarque qu'un non-métal est l'exact contraire d'un métal ...
|
|
|
|
||
|
|
|
 |
 |
|
|
 |
 |
||
|
 |
 |
||
|
|
|
|
||
|
|
Elevé |
 Faible Faible |
||
|
|
|
Faible |
Importante |
|
|
|
 |
 |
||
 |
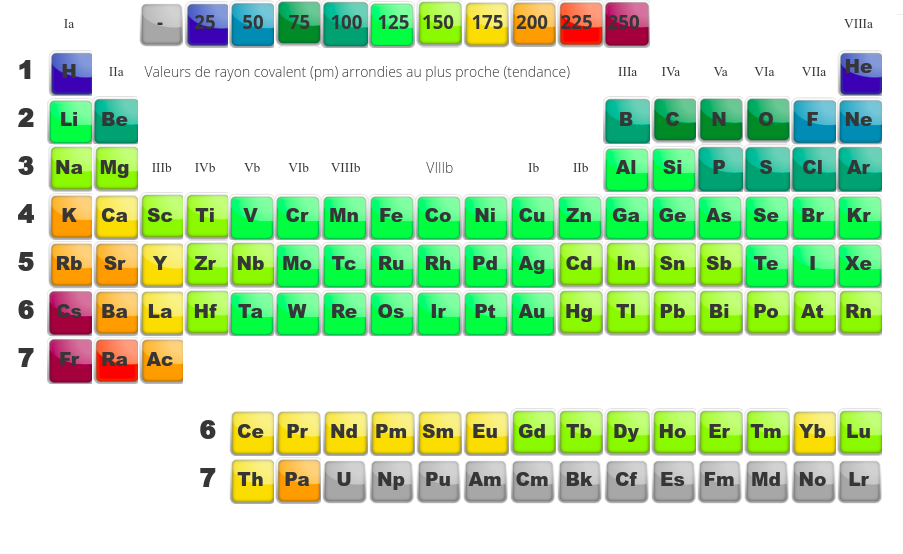
La taille des atomes, un paramètre révélateur
|
||||
Finalement, dans l'étude du tableau périodique, il nous reste à parler de la taille des atomes. En remplissant le tableau périodique case par case, nous pouvons remarquer que deux phénomènes se passent :
- Le noyau se peuple peu à peu en nucléons (protons et neutrons)
- Le nuage électronique se peuple en électrons (qui souhaitent se repousser)
Globalement, en ajoutant un proton à chaque case, on a tendance à rapprocher peu à peu les électrons du noyau puisque d'avantage de charges positives les attirent ... tant que l'on rempli une mêmecouche électronique. Dès que l'on entame une nouvelle couche électronique, ces nouveaux électrons, plus en périphérie ressentent moins le noyau. Cette dernière couche est donc plus ample, prend plus de place.
La conclusion est simple :
- Dans une période, la taille des atomes a tendance à diminuer car même si on ajoute des électrons (ce qui devrait amener une augmentation du volume du nuage électronique et donc de l'atome), l'augmentation assez importante de la charge du noyau contracte le nuage électronique.
- Dans une famille maintenant, les deux tendances vont dans le même sens puisque l'on augmente à la fois le nombre d'électrons et on augmente le nombre de couches électroniques, la taille de l'atome augmente.
Dans le diagramme de droite, on remarque bien que chaque fois que l'on change de période, on a une augmentation brusque de la taille des éléments (on passe d'élements avec un nuage électronique fort compacté en fin de période à des éléments auquels on ajoute subitement une nouvelle couche en début de période). Entre deux pics, on a une diminution régulière de la taille qui correspond à l'augmentation de la charge du noyau et à la contraction au fur et à mesure du nuage électronique au fil d'une période.
 |
Les autres informations du tableau périodique | ||||
En fonction du tableau périodique, nous pouvons retrouver des informations plus ou moins nombreuses dans chaque case. Certains tableaux périodiques chercheront à être simples et compréhensibles pour tous, généralement ceux dédiés à l'enseignement secondaire ... et d'autres au contraire chercheront à être les plus complets possibles ... ceux dédiés à l'enseignement supérieur.
Nous avons choisi de vous montrer cette différence en prenant deux exemples : le tableau iss du site wikipédia et le bien connu provenant de la société UCB. On peut remarquer une grande différence en terme de nombre d'informations. Alors que celui de wikipédia se limite à présenter des informations essentielles liées à la structure de l'atome (comme nous l'avons fait ici), celui d'UCB reprend de nombreuses informations liées cette fois à la matière (chaleurs de changement d'état, ...) ou des valeurs atomiques plus pointues (énergie d"ionisation, ...).
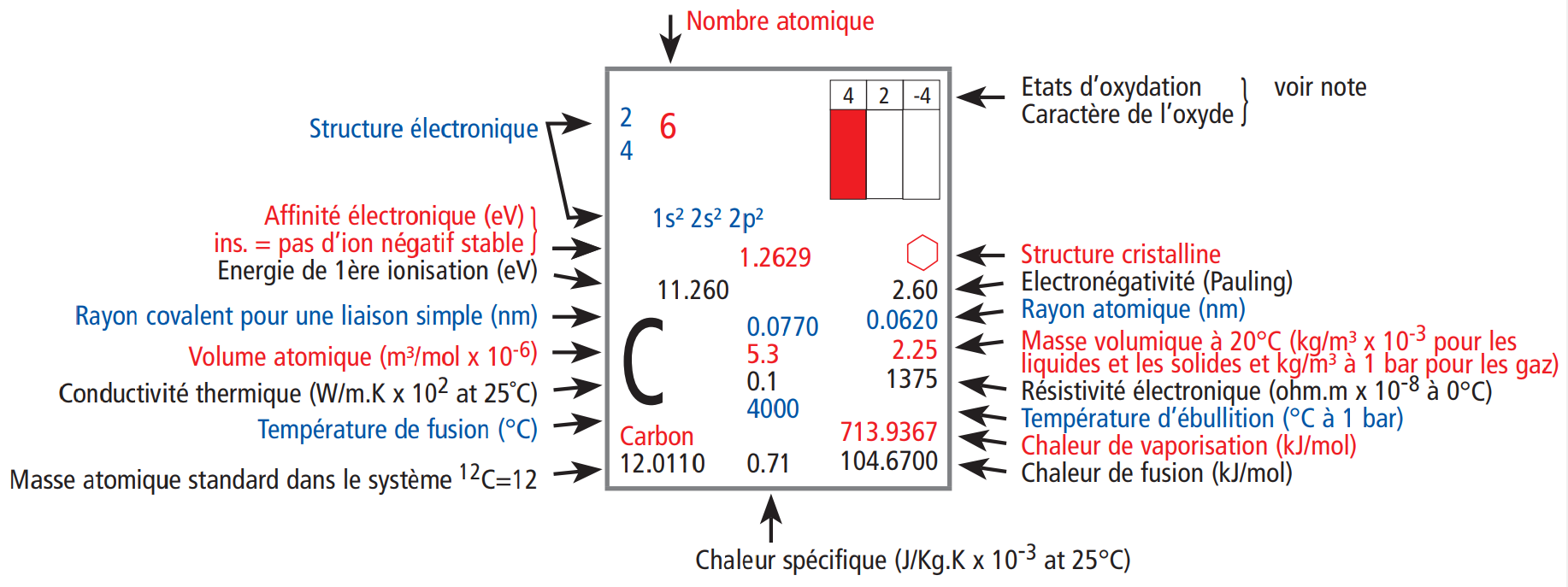 |
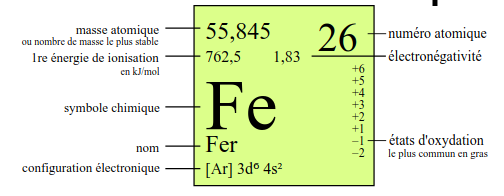 |
| Description des des cases du tableau périodique UCB | Description des des cases du tableau périodique WIKIPEDIA |
Dans tous les cas, les informations indispensables sur un tableau périodique sont :
- Le nom de l'élément
- Le symbole de l'élément
- Le nombre atomique
- La masse atomique relative
- La structure électronique de l'atome (soit selon Bohr {KLMNOP}, soit selon le modèle orbitalaire {1sX ...}
- L'électronégativité (dont nous allons parler rapidement)
Toutes les autes informations peuvent être utiles mais pas essentielles. On remarquera déjà que la structure élctronique peut être retrouvée facilement comme nous l'avons vu mais pour gagner du temps, il est toujours bon de pouvoir l'avoir sous la main.
|
{aridoc engine="google" width="750" height="1050"}images/Telechargements/Chimie/TPUCB-2A4.pdf{/aridoc}
Pour vos cours, nous vous conseillons d'imprimer et d'utiliser le tableau UCB. A l'origine, c'est un tableau périodique au format A3. Nous vous proposons une version que nous avons retravaillée afin d'imprimer le tableau sur deux feuilles A4 que vous pouvez alors assembler pour retrouver le tableau périodique A3.
|
|
|
La variation du nombre d'électrons, base de la formation des ions élémentaires | ||||
Mais pourquoi donc y-a-t-il des éléments qui ont des propriétés si différentes ? Nous l'avons vu, mais il est bon de le rappeler et de l'expliquer, leurs positions dans le tableau périodique sont diamétralement opposées. Comme la classification périodique est basée sur les propriétés physico-chimiques (propriétés physiques et chimiques), il est normal que rien ne soit plus différent d'un métal qu'un non-métal.
Regardons d'un peu plus près ce qui pousse les éléments à réagir si différemment. Dans le tableau périodique, une colonne est très importante pour comprendre cela, c'est la dernière colonne ; celle des gaz inertes. Si ils sont inertes, c'est parce qu'ils ne réagissent pas, ils ne souhaitent pas changer de structure électronique .... Quand on ne souhaite pas changer, c'est que l'on est bien comme on est ; on est stable ... Quand nous regardons leur structure électronique, nous nous apperçevons que leur dernière orbitale est complète ; elle contient le maximum d'électrons. C'est ce qui les rend si particuliers, si stables, si inertes !
En soi, tous les éléments souhaitent atteindre cette stabilité, ressembler aux gaz rares et pour y arriver, avec le moins d'effort (le moins de dépense énergétique), il leur faut des stratégies différentes car leurs structures électroniques sont parfois très différentes. Il vont choisir de faire correspondre leur structure électronique à celle du gaz inerte le plus proche (et s'entourer de 8 électrons), c'est ce que l'on appelle la règle de l'octet ... qui a ses limites ...
Nous expliquerons plus en détail ce qui se passe lors de la formation de molécules ou d'ions, ainsi que les notations à utiliser dans le chapitre dédié aux molécules. Nous allons simplemen, ici, expliquer la tendance naturelle des éléments à former des molécules ou des ions.
Prenons les familles "a" pour l'expliquer facilement :
 |
Ceux de gauche (les familles Ia, IIa et IIIa), les métaux, ont un, deux ou trois électrons en plus qu'un gaz rare, ils auront tendance à les perdre pour ressembler plus facilement à un gaz inerte : le précédent. |
 |
 |
||
 |
||
| Ceux de droite (les familles VIIa, VIa et Va), ont à peu de chose près, la structure d'un gaz rare, il leur manque un, deux ou trois électrons. Ils auront plus facile de prendre les électrons qui leur manque. |  |
|
 |
||
 |
| Finalement comme il y a 8 familles "a" ; il y a ceux qui sont au milieu (la famille IVa) ... et qui ont 4 électrons célibataires. Ceux là pourront prendre ou perdre leurs 4 électrons. |  |
|
Si certains éléments prennent ou perdent des électrons (et nous verrons pourquoi et comment plus loin), il y aura un déséquilibre entre le nombre de protons dans le noyau (qui n'à pas changé) et le nombre d'électrons qui lui aura changé. On ne les appelera plus des éléments (un élément est par définition neutre) mais des ions. On poura ainsi avoir :
On a donc, en fonction de leur position dans le tableau, des éléments qui auront tendance à prendre des électrons et d'autres qui auront tendance à les perdre. Ce constat nous amène à définir un nouveau concept, celui de l'électronégativité : |
 |
L'électronégativité est la tendance d'un atome à garder ses électrons et à en attirer d'autres.
Nous dirons donc que les métaux (qui ont tendance à perdre leurs électrons) seront moins électronégatifs que les non-métaux qui auront tendance à garder leurs électrons et à en attirer d'autres.
Si on recolorie le tableau périodique en prenant comme code couleur que
- plus l'élément est électronégatif il sera rouge (maximum : le fluor en bordreau)
- moins l'élément est électronégatif il sera bleu (minimum : le francium en bleu foncé)
Nous obtenons un nouveau visuel du tableau périodique qui décrit fort bien cette tendance qu'est l'électronégativité. On remarque que l'électronégativité augmente lorsque l'on remonte une famille ou quand on parcours une période de gauche à droite. Certains éléments peuvent sortir de cette logique, cela leur confert généralement des propriétés particulières.
 |
La modification de la structure électronique sans variation de quantité d'électrons : l'hybridation |
||||
Il arrive que l'existence de certaines molécules ne soit pas compatible avec la structure électronique des atomes telle que nous l'avons décrite jusqu'ici. Il nous faut donc adapter la théorie et ajouter une page en plus à notre modèle atomique. Ces modifications peuvent prendre plusieurs formes mais dans tous les cas, elle répond à une logique de stabilité. L'objectif est d'atteindre, à terme, un état globalement plus stable (moins énergétique - nous en reparlerons) malgré que ces modifications soient souvent source d'augmentation momentanée d'énergie pour l'atome.
Une nouvelle correction doit être apportée au modèle atomique afin de pouvoir expliquer certaines incohérences dont nous allons parler juste après. On appelle cette correction l'hybridation ... Le principe de l'hybridation est de mélanger certaines orbitales, certaines vides, certaines pleines afin de redistribuer les électrons d'une autre façon et soit de désapparier des doublet pour s'offrir d'avantage d'électrons célibataires (et faire plus de liaisons) ou d'apparier des électrons afin d'obtenir un doublet en plus et de s'offrir une orbitale vide permettant à terme d'accepter un doublet et de faire une liaison.
Le désappariement
|
Les plus grandes incohérences proviennent d'un atome en particulier, le carbone. Le carbone possédant 6 électrons, on peut, selon le moyen mnémotechnique proposé lors de la présentation du modèle orbitalaire, définir sa structure électronique : 1s2 2s2 2p2 Cette structure électronique proposée laisse entrevoir pour la dernière couche du carbone un doublet électronique (2s2) et deux électrons célibataires (2p2). En réalité, la seule molécule possédant un carbone de ce type est la molécule de monoxyde de carbone (CO). Cette structure est en totale contradiction même avec la position de l'atome de carbone dans le tableau périodique qui prévoit 4 électrons célibataires. |
 |
La solution trouvée est d'ajouter la possibilité au carbone, par une hybridation, de mélanger l'orbitale 2s et les 3 orbitales p ... pour en faire 4 nouvelles orbitales appelées sp3 (nom rappelant le type et le nombre d'orbitales mélangées). On peut alors redistribuer les 4 électrons en en plaçant un seul sur chacune des 4 orbitales créées. On arrive à un carbone tétrahédrique :
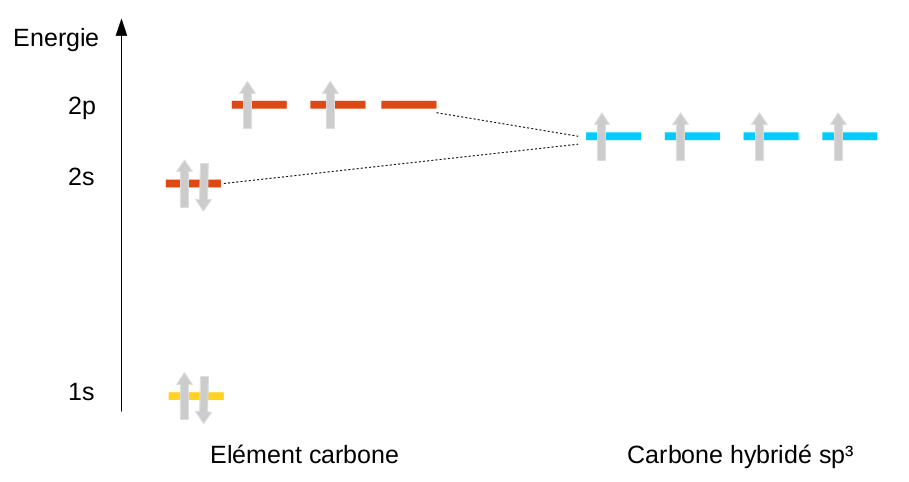
En ne mélangeant qu'une partie des orbitales, on peut aussi expliquer l'existence de doubles (hybridation sp2) et de triples liaisons (hybridation sp) pour le carbone, mais nous en reparlerons en chimie organique.
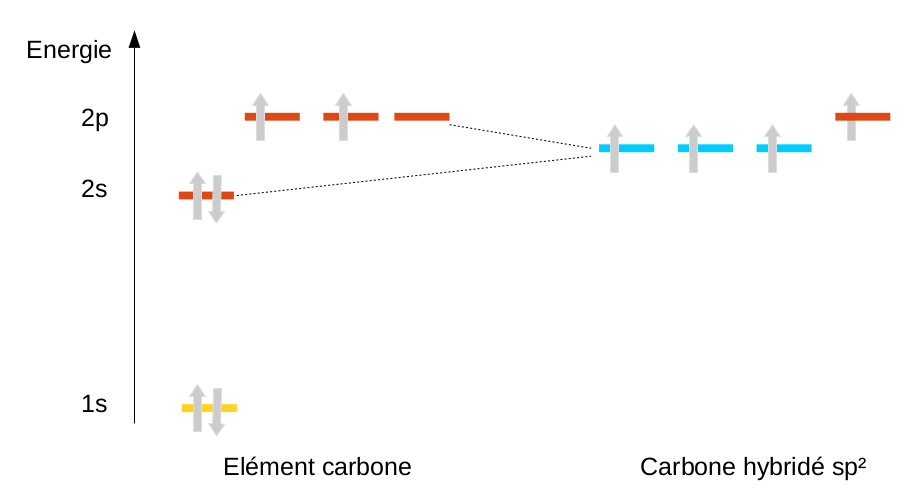 |
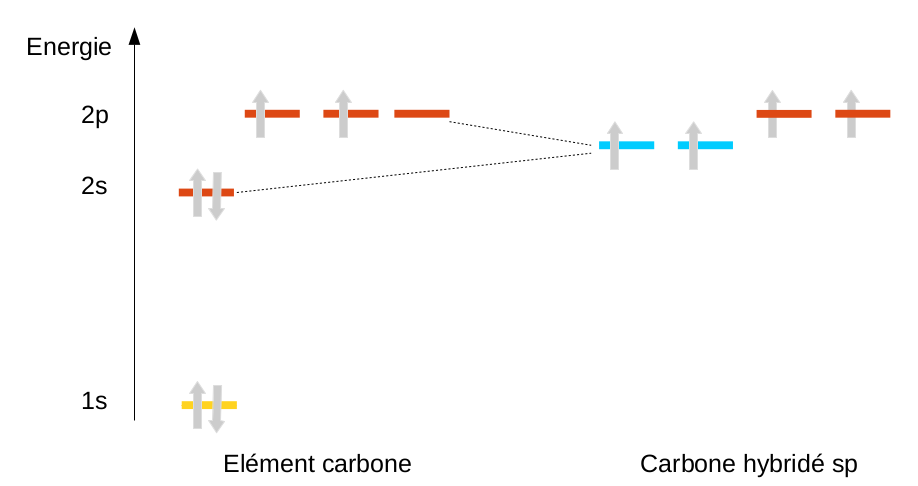 |
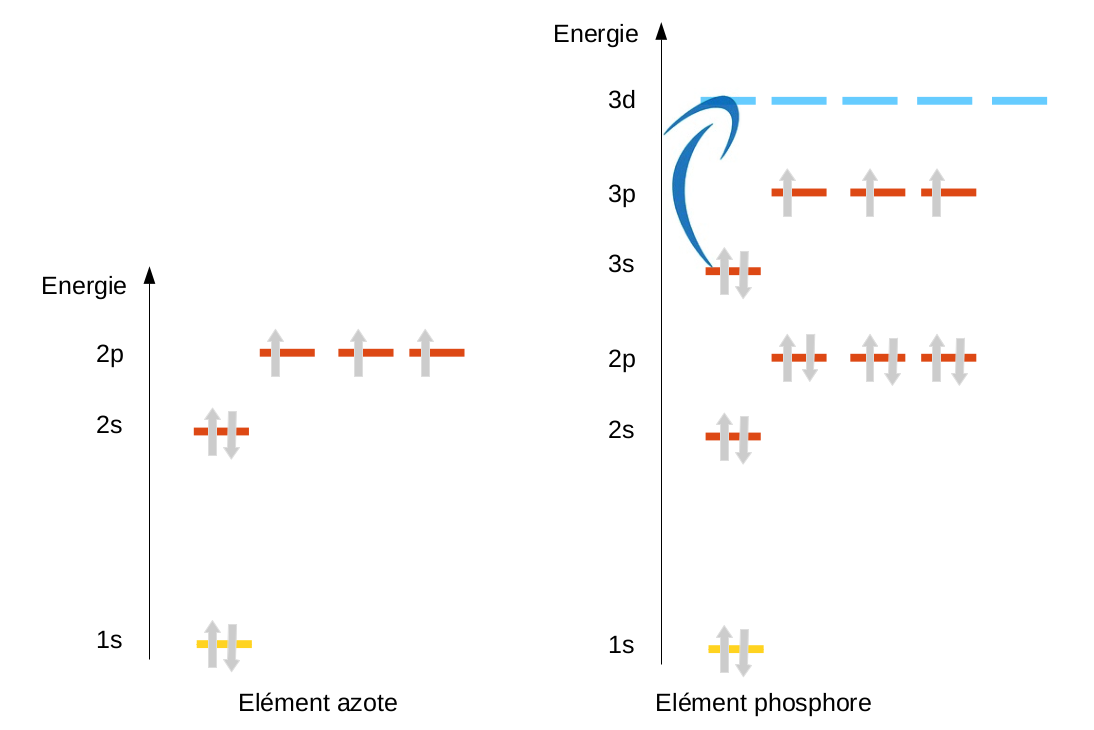
L'appariement
Dans certains cas, c'est le contraire dont on a besoin pour justifier l'existence de certaines molécules. Nous le verrons plus tard, quand nous parlerons liaisons et formation de molécules, mais il arrive que nous devions justifier des liaisons difficilement justifiables sans hybridation. C'est par exemple le cas de l'acide nitrique (HNO3).
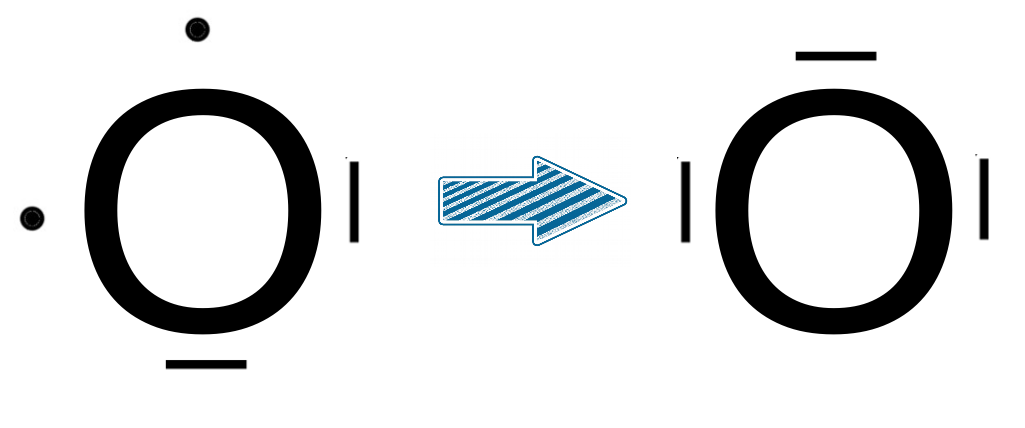 |
C'est par exemple le cas de l'oxygène qui aurait besoin d'une orbitale vide pour accepter un doublet alors que toutes ses orbitales contiennent des électrons (2 doublets et deux électrons célibataires). L'objectif ici sera d'utiliser l'hybridation pour justifier que les deux électrons célibataires vont s'apparier dans la même orbitale afin de créer une orbitale vide. |