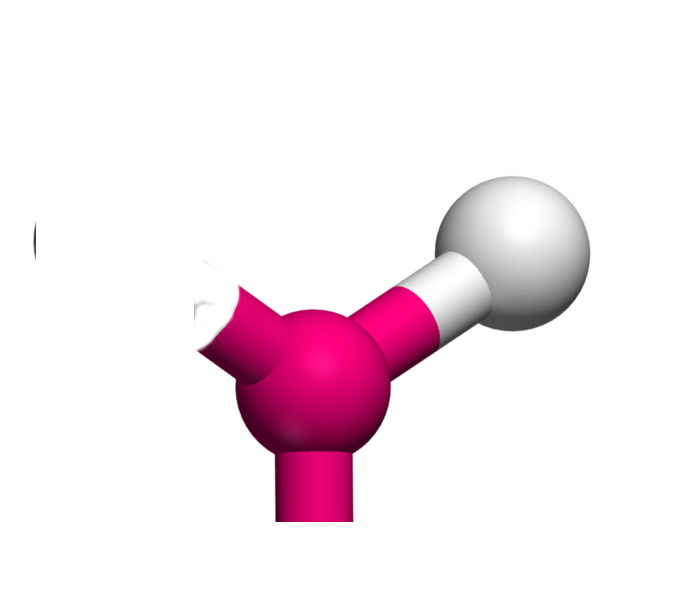Tout savoir sur ... les molécules
|
sur les concepts théoriques importants
Animations |
Dans chaque type de jeux, différents plateaux sont disponibles et proposés de façon aléatoire. Vous pouvez donc vous exercer à plusieurs reprises sur chaque jeu.
|
|
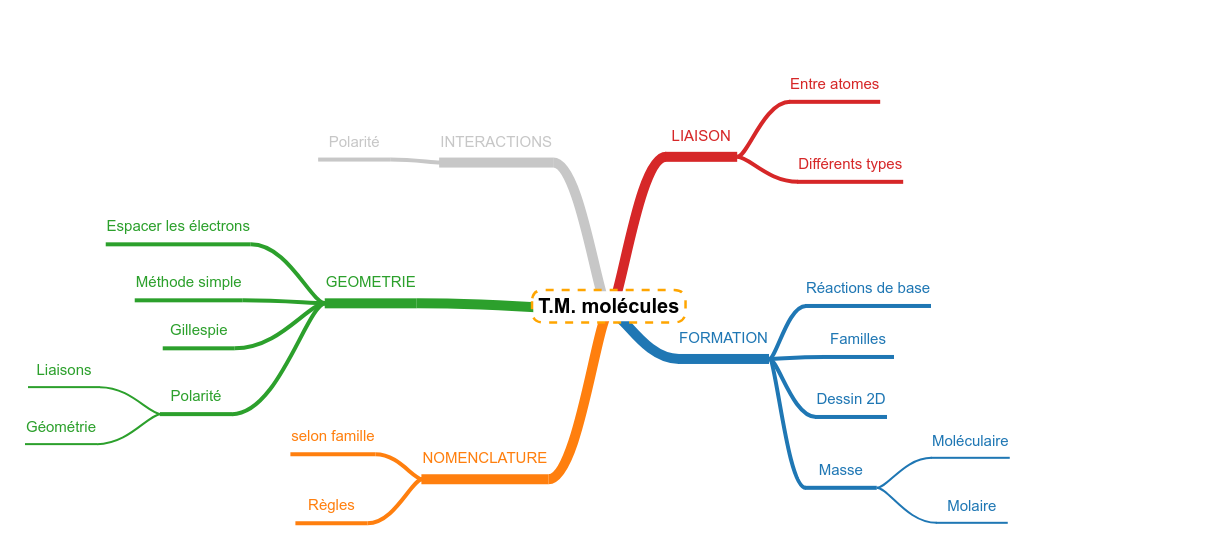
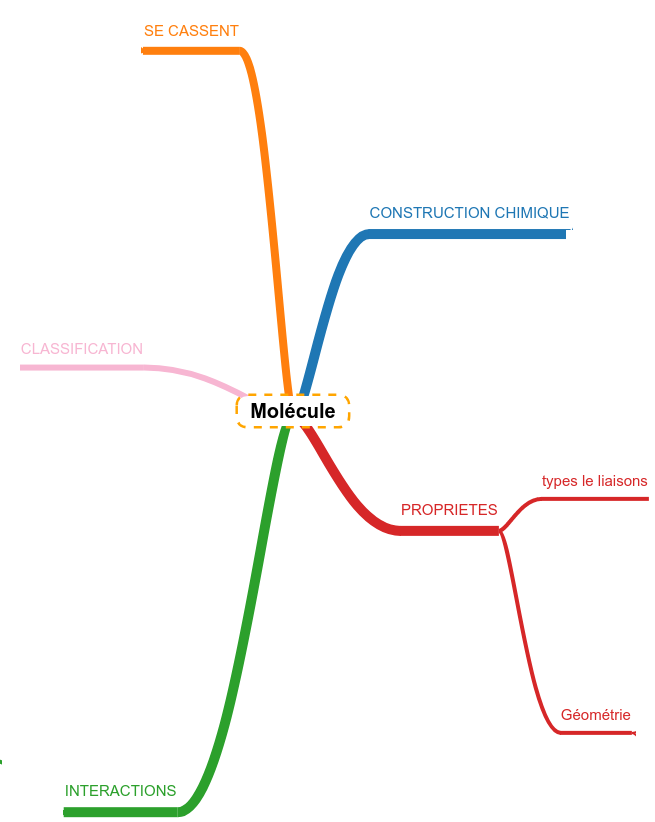
Les résumés sont construits autour d'une carte heuristique (mindmap) simplifiée qui représente le plan de la connaissance à maîtriser concernant le sujet central. Chaque branche de cette carte représente une question potentielle que l'on peut vous poser sur la matière. Au bout de chaque branche, un logo montre que quelque chose est attaché. Il s'agit du reste de la carte qui s'ouvre dans un popup. Chaque partie de la carte est "lue" : un texte est proposé en guise de "réponse". Revoir, c'est s'entraîner à générer ce que contiennent les différents popup.
|
||
 |
Déterminer le nom d'une molécule
Déterminer la masse molaire d'une molécule Déterminer la famille d'une molécule Déterminer la structure moléculaire
|
 |
Si après avoir travaillé la matière avec les outils du site, vous avez encore des questions ou besoin d'un coaching méthode, vous pouvez nous contacter. Notre équipe didactique se fera un plaisir de vous aider.
|
Les propriétés atomiques dont nous avons parlé dans le chapitre consacré à l'atome et la tendance qu'ont les éléments à chercher à obtenir une dernière couche électronique complète mènent à associer les atomes entre eux pour former des structures plus grandes composées d'atomes liés entre eux que l'on appelle molécules. Mais comment sont-ils liés ? Quels implications ces différents liens peuvent avoir sur les propriétés de ces nouveaux édifices dits "moléculaires" ? |
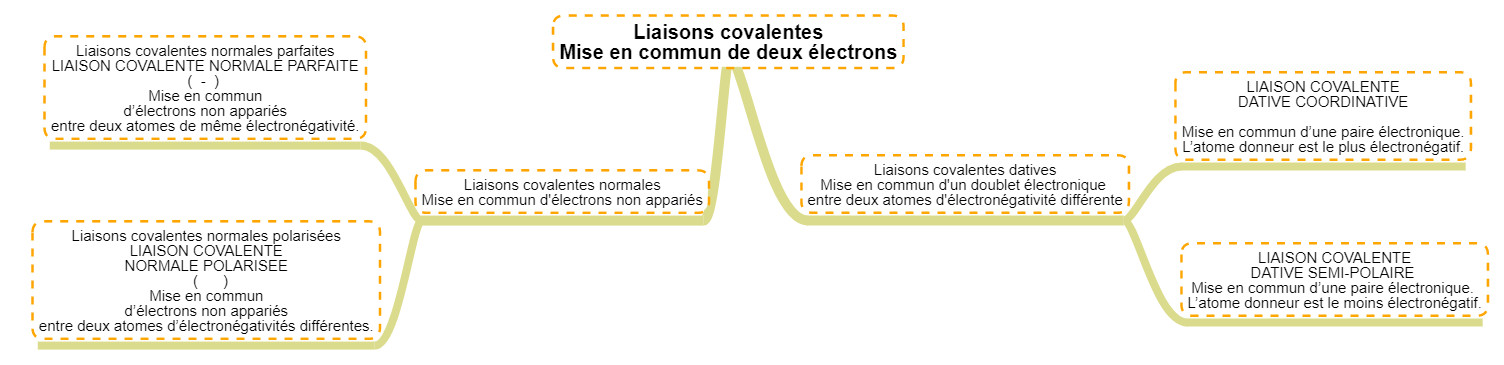
Les liaisons, ces liens chimiques particuliers Réaliser une liaison chimique c'est donc ... partager les électrons (les mettre en commun). Comme il existe des électrons célibataires et des doublets électroniques sur la dernière couche des éléments, il y aura deux grands types de liaisons différentes. Toutes les liaisons sont appelées liaisons COVALENTES car elles lient deux atomes. Laisons normales Le premier type de liaison est celui auquel on s'attend selon la théorie atomique : deux atomes possédant chacun un électron célibataire vont chercher à le mettre en commun afin de créer un doublet (qui est une configuration plus stable). En fonction de la différence d'électronégativité des atomes, il peut y avoir deux types de liaison normales :
Lorsque les deux atomes qui se lient ont strictement la même électronégativité, on a une liaison totalement symétrique. Les deux électrons partagés sont parfaitement au milieu des deux atomes. Aucun atome ne tire à lui ces électrons. Exemple : la molécule de H2 : H-H. C'est le cas de toutes les molécules diatomiques symétriques (O2, N2, Cl2,...) qui sont composées de liaisons covalentes normales parfaites puisqu'elles sont constituées de deux atomes identiques.
Si par contre il y a une différence d'électronégativité, la répartition des électrons sera asymétrique. L'atome le plus électronégatif tirera à lui les électrons de la liaison. Ceci veut dire que : Exemple : La molécule de HCl : H-Cl montre une différence importante d'électronéativité entre les deux atomes. L'atome de chlore (électronégativité de 3) portera une charge partielle négative alors que l'atome d'hydrogène (électronégativité de 2,1) portera une charge partielle positive (delta +). Remarque : la différence d'électronégativité ne doit pas dépasser 1,7. Si cette valeur est dépassée, un des deux atome arrachera l'électron de l'autre. Il n'y aura donc plus d'électrons mis en commun, il n'y aura plus de liaison.
Lorsque un atome prend un électron à un autre, on a plus de liaison entre eux, nous avons des ions. Nous parlerons alors de charge formelle. Nous aurons une paire d'ions : Par contre, dans le cas d'une liaison polarisée, il n'y a pas de capture d'un électron par l'atome le plus électronégatif, il y a juste un déplacement de la densité électronique de la liaison vers l'atome le plus électronégatif. Alors que dans une liaison normale parfaite, il y a une densité électronique symétrique et centrée sur le milieu de la liaison, ici, nous verrons une dissymétrie. Il faut alors trouver une solution pour aratériser ce déplacement de charge. Nous ne pouvons pas, comme avant, placer des + ou des - car nous n'avonns pas de charge formelle. Nous allons alors attribuer à chaque atome une charge partielle (notée delta minuscule) suivie d'un + ou d'un - pour dire qui a une densité électronique plus importante ou moins importante. A droite, une animation, montrant cette dissymétrie et les charges partielles. En bas, des exemples de molécules (CO2 et NH3) montrant les portions de charges attribuées à chaque atome. Comme ces charges sont inférieures à 1, on voit qu'elles sont bien partielles.
Liaisons datives Le second type de liaison, est différent du premier car il ne s'agit plus ici de mettre en commun des électrons célibataires mais de partager le doublet libre d'un des deux atomes. Pour réaliser ce type de liaison il faut absolument : Evidemment, ce partage passe également par le mélange des orbitales atomiques concernées et la formation d'une orbitale moléculaire.
Il existe à nouveau deux type de liaisons datives en fonction des différences d'électronégativité des atomes : Les liaisone datives coordinatives sont bien moins solides que les autres, ceci s'explique par le caractère inhabituel du partage puisque ce n'est généralement pas l'atome le plus éectronégatif qui donne ses électrons. Cette liaison est cependant très importante en chimie car elle est présente dans les ions H3O+ et NH4+. Voici un résumé visuel : Ce n'est pas parce qu'un atome possède un doublet électronique, qu'il fera des liaisons datives ! En réalité, bon nombre d'atomes peuvent désapparier leur doublet afin de réaliser des liaisons covalentes normales. Les principaux atomes qui ne le peuvent pas sont l'oxygène et l'azote Patager des électrons, c'est aussi potentiellement en gagner ou en perdre Les atomes partagent des électrons pour faire des liaisons et en fonction de leur électronégativité ... les électrons se rapprochents d'un atome et s'éloignent de l'autre. Ce déplacement d'électrons amènent une différence dans l'entourage électronique des atomes par rapport à celle de l'élément dans le tableau périodique. Nous attribuerons donc : Notons qu'une double liaison impliquera le transfert de deux électrons. Une triple impliquera le transfert de 3 électrons ...



 |
Classer les molécules |
||||
A partir des structures de Lewis des atomes et des différents types de liaisons, nous allons pouvoir assembler les atomes pour créer des molécules.
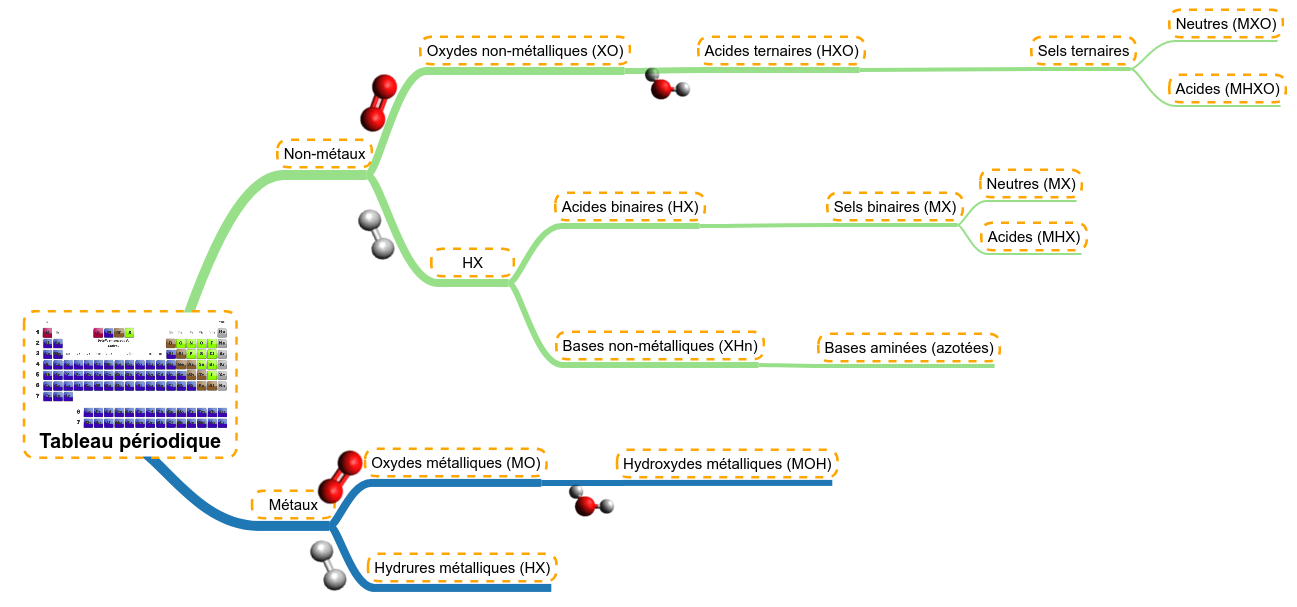
Mais avant cela, expliquons comment les molécules se créent à partir du tableau périodique et quels sont les différentes familles de molécules qui existent. Cela nous aidera pour la suite ....
Nous avons vu que dans le tableau périodique, on pouvait trier les atomes selon deux grandes tendances :
- ceux dont l'électronégativité était faible, à caractère métallique
- ceux dont l'électronégativité était bien plus élevée, à caractère non-métallique
Nous partirons donc de ces deux catégories afin d'appliquer 4 grands types de réactions :
- réaction avec de l'oxygène (oxydation)
- réaction avec l'eau (hydratation)
- réaction avec l'hydrogène
- réaction de neutralisation (nous en reparlerons plus longuement).
 |
Dessiner les molécules |
|
 |
Déterminer la masse des molécules |
|
Un paramètre important, dont nous nous servirons souvent en chimie, est la masse des molécules. Elle nous permettra de déterminer des quantités de matière par la suite.
La masse d'une molécule, c'est (simplement) la somme des masses des atomes qui la composent
Ainsi calculer la masse d'une molécule c'est faire des additions et des multiplications. Nous obtenons un chiffre exprimé en u.m.a ; la masse moléculaire.
La masse moléculaire relative est ce même nombre, divisé par 1 uma, soit, sans unité.
La masse molaire est toujours ce même nombre accompagné de l'unité (g/mol). Elle représente la masse d'une mole (6,02 1023 molécules) de ce corps.
N'oublions pas les cristaux !
 |
Actuellement, nous avons considéré les molécules toutes seules. Nous avons considéré que ces matières parfois solides ne comportaient pas d'eau (anhydre). Ce n'est pas toujours le cas, il arrive bien souvent que nous ayons des substances cristallisées. Dans ce cas, un certain nombre de moécules d'eau sont présentes dans les cristaux, attachées aux molécules de ce corps. On fait alors suivre leur formule d'un point et du nombre de molécules d'eau attachées : Cr(NO3)3•9H2O Dès que l'on voit une telle structure, il faut ajouter à la masse de la molécule (le nitrate de chrome (III) dans notre exemple), la masse des molécules d'eau (on ajoutera ici 9x 18g/mol). |
Certaines molécules en se cassant forment des ions ... polyatomiques, c'est la dissociation Nous avons vu que les ions sont des particules chargées qui peuvent être monoatomiques (un atome qui gagne ou qui perd des électrons). Ces ions peuvent aussi être polyatomiques (composés de plusieurs atomes), il s'agit alors de parties de molécules. En effet, certaines molécules ont des liaisons plus fragiles qui peuvent se rompre. Souvent, la rupture d'un telle liaison est la conséquence d'une différence d'électronégativité assez importante entre deux atomes. La rupture se réalise alors de façon hétérolytique : les deux électrons de la liaison se déplacent sur un atome. Cela génère deux fragments chargés (ions) : Exemple : H2SO4 → 2 H+ + SO4-- Dans un premier temps, le plus facile est de pouvoir retenir les ions polyatomiques les plus courants ainsi que leur charge. Cela sert à construire facilement les structures moléculaires et à écrire les produits de réaction. Voici les ions classés par élément :


La nomenclature est une étape importante dans l'apprentissage de la chimie. Il s'agit d'apprendre à nommer correctement chacune des molécules existantes afin de pouvoir communiquer correctement entre scientifiques. C'est l'Union internationale de chimie pure et appliquée (IUPAC) qui développe et met à jour ce système de nomenclature international.
Cette partie, parfois vue comme rébarbative à cause des règles qu'elle impose, doit être vue, non pas comme un apprentissage par coeur mais comme un savoir faire que l'on développe en appliquant des règles fixées à chaque molécules. Prendre les règles à côté de soi lorsque lon fait des exercices est donc important.
La nomenclature de ces dérivés est la plus simple, elle se résume à une règle : Nom du dérivé + de (d') + nom du métal + (valence) Le nom du dérivé sera simplement : Comme en français, si le nom du métal commence par une voyelle, on éludera le 'e' du de pour donner d' Suivra ensuite le nom du métal, celui qui est inscrit dans le tableau périodique des éléments. Finalement, si le métal possède plusieures valences, nous indiquerons cette dernière en chiffres romain entre parenthèse. Cela ne concerne que quelques éléments de la famille des métaux de transition dont nous reprenons les plus courants dans le tableau suivant : Exemples :
Les oxydes métalliques (MO) préfixe + Oxyde + de (d') + nom du non-métal Le préfixe va dépendre du rapport du nombre d'oxygène de la molécule par rapport au nombre de non-métal selon le tableau suivant : Comme en français, si le nom du non-métal commence par une voyelle, on éludera le 'e' du de pour donner d' Suivra ensuite le nom du non-métal, celui qui est inscrit dans le tableau périodique des éléments. Exemples : Les acide ternaires ou oxacides (HXO) Acide préfixe + nom du non-métal + suffixe Le nom du non-métal peut-être un peu adapté selon le tableau suivant : Les autres non-métaux perdent leur 'e' final. Les préfixes et les suffixes sont fonction de la richesse en oxygène selon le tableau suivant : Le soucis de la richesse, c'est qu'elle est relative, on est toujours pauvre ou riche par rapport à d'autres; l'application de cette règle nécessite de savoir combien d'acides ternaires il existe pour chaque non-métal; le tableau suivant reprend les plus fréquents : Exemples : HClO = acide hypochloreux H2SO3 = acide sulfureux HBrO4 = acide perbromique HNO3 = acide nitrique Les exceptions Malheureusement, il existe des exceptions ou du moin, des molécules qui ne répondent pas complètement à cette nomenclature ; il existe différents cas : Les thioacides Les thioacides sont des HXO auxquels, on a substitué un atome d'oxygène par un atome de soufre. Ainsi la molécule H2S2O3 dérive directement de l'acide sulfurique (H2SO4) auquel on a remplacé un oxygène par un soufre. Dès lors, on l'appelera l'acide thiosulfurique. La règle sera donc d'ajouter 'thio' en préfixe Les diacides Les diacides sont des acides provenant de l'association de deux molécules d'acide avec création d'une molécule d'eau (on appelle cela la condensation de deux molécules). Un exemple provient des acides du chrome : alors que l'acide H2CrO4 est apppelé acide chromique, en les association, on arrive à la molécule H2Cr2O7, appelée acide dichromique. 2 H2CrO4 --> H2Cr2O7 + H2O La règle sera donc d'ajouter 'di' en préfixe C'était déjà le cas précédemment avec l'acide chromique, certains métaux produisent aussi des acides. Il s'agit de certains étages d'oxydation de métaux de transition. La majorité d'entre eux respectent bien les règles de nomenclature. Par contre, les acides du manganèse (Mn) sont particuliers ainsi : Le mieux est de noter cette différence, de la connaître. Les acides peuvent aussi être considérés comme des sels (MXO) d'hydrogène. Ils ont donc deux noms. Nous apprendrons ce second nom dans la partie réservée aux sels en remplaçant le nom du métal par 'hydrogène'. Les acides binaires ou hydracides (HX) Acide nom du non-métal + hydrique Le nom du non-métal peut-être un peu adapté selon le tableau suivant : Les autres non-métaux perdent leur 'e' final. Exemples : Les acides peuvent aussi être considérés comme des sels (MX) d'hydrogène. Ils ont donc deux noms. Nous apprendrons ce second nom dans la partie réservée aux sels en remplaçant le nom du métal par 'hydrogène'. Les bases non-métalliques (XHn) Quelques molécules contenant des non-métaux (ou métalloïdes) ne forment pas d'acides mais des bases. Voici un tableau comportant leurs structures; leur nom usuel (en vert) et des noms officiels peu utilisés. Ces bases mènent à des ions dont un est très important, l'ammonium Le suffixe 'ane' est utilisé en référence aux 'alcanes' en chimie organique ; ces composés ne comportant que des atomes de carbone et d'hydrogène. D'autres composés non métalliques ne sont pas des bases :
Les sels binaires ou sels d'hydracides (MX) nom du non-métal + ure + de (d') + nom du métal + (valence) Le nom du non-métal peut-être un peu adapté selon le tableau suivant (le même que pour les HX) : Les autres non-métaux perdent leur 'e' final. Finalement, si le métal possède plusieres valences, nous indiquerons cette dernière en chiffres romain entre parenthèse. Cela ne concerne que quelques éléments de la famille des métaux de transition dont nous reprenons les plus courants dans le tableau suivant (le même que présenté pour les oxydes et hydroxydes métalliques) : Exemples : Les sels ternaires ou sels d'oxacides (MXO) préfixe + nom du non-métal + suffixe + de (d') + nom du métal + (valence) Le nom du non-métal peut-être un peu adapté selon le tableau suivant : Les autres non-métaux perdent leur 'e' final. Les préfixes et les suffixes sont fonction de la richesse en oxygène selon le tableau suivant : Finalement, si le métal possède plusieres valences, nous indiquerons cette dernière en chiffres romain entre parenthèse. Cela ne concerne que quelques éléments de la famille des métaux de transition dont nous reprenons les plus courants dans le tableau suivant (le même que présenté pour les oxydes et hydroxydes métalliques) : Exemples : Les hydrogénosels (MHX et MHXO) Lorsqu'un acide (HX ou HXO) possède plusieurs hydrogènes acides, il est possible de ne faire réagir qu'une partie de ces hydrogènes en mettant moins de base que nécessaire à la réaction complète (nous en reparlerons pls longuement après). Ces sels possèdent donc encore la possibilité de réagir avec des bases, ce sont des sels acides, aussi appelés hydrogénosels. Exemple : H2SO4 + NaOH --> NaHSO4 + H2O NaHSO4 + NaOH --> Na2SO4 + H2O NaHSO4 est appelé hydrogénosulfate de sodium pour le diférencier du sulfate de sodium (Na2SO4) La règle sera donc d'ajouter 'hydrogéno' en préfixe pour chaque hydrogène acide restant. Avec deux hydrogènes, le NaH2PO4 s'appelera le dihydrogénophosphate de sodium.
Les exceptions Malheureusement, il existe deux exceptions qui sont les deux acides du phosphore H3PO3 et H3PO2 . Ce problème provient de la structure même de ces deux molécules qui a une implication importante sur leurs propriétés chimiques. H3PO4 La molécule d'acide phosphorique ne pose aucun soucis, nous la prenons comme exemple. Nous pouvons voir qu'elle contient 3 groupements O-H, la différence d'électronégativité entre l'oxygène et l'hydrogène étant assez importante (1,3), ces 3 hyrogènes sont, comme pour la toute grande majorité des HXO, acides. La réaction de cette molécule avec des bases permet de générer 3 ions : H3PO3 La molécule d'acide phosphoreux, elle, a un oxygène en moins. L'atome d'oxygène qui n'et pas présent est l'un des trois qui portait un hydrogène dans la molécule d'acide phosphorique. On a alors un hydrogène directement lié à l'atome de phosphore. La différence d'électronégativité n'est plus que de 0,3. Cette liaison P-H n'est plus assez polarisée que pour générer un hydrogène acide (capable de partir sous forme de H+), cet acide n'a plus que deux fonctions acides, ne générant que deux ions : Comme un hydrogène n'est plus acide, nous ne mettons pas hydrogéno pour lui, il y a donc une différence entre le nombre d'hydrogènes portés par la molécule et le nombre de préfixes 'hydrogéno' représentant des hydrogènes acides dans le nom. H3PO2 Le même scénario se reproduit pour la molécule d'acide hypophosphoreux amenant cette fois deux liaisons P-H et donc deux des trois hydrogène ne sont plus acides. Il ne reste alors à l'acide qu'une seule fonction, amenant un seul ion : La nomenclature en chimie minérale
+I
+II
+III
+IV
+V
+VI
Fer (Fe)
Fe2+
Fe3+
Cuivre (Cu)
Cu+
Cu2+
Chrome (Cr)
Cr3+
Cr6+
Titane (Ti)
Ti2+
Ti3+
Plomb (Pb)
Pb2+
Pb4+

Nom de l'élément
Nom utilisé
Azote
Nitr
Soufre
Sulfur
Richesse en O
Préfixe
Suffixe
Très pauvre
Hypo
eux
Pauvre
eux
Riche
ique
Très riche
Per
ique
Très pauvre
Pauvre
Riche
Très riche
Carbone
H2CO3
Azote
HNO2
HNO3
Soufre
H2SO3
H2SO4
Phosphore
H3PO2
H3PO3
H3PO4
Chlore, brome et iode (X)
HXO
HXO2
HXO3
HXO4
Nom de l'élément
Nom utilisé
Soufre
Sulf
NH3
Ammoniac
Azane
PH3
Phosphine
Phosphane
NH4+
Ammonium
PH4+
Phosphonium
BH3
Borane
SiH4
Silane
CH4
Méthane
Nom de l'élément
Nom utilisé
Soufre
Sulf
+I
+II
+III
+IV
+V
+VI
Fer (Fe)
Fe2+
Fe3+
Cuivre (Cu)
Cu+
Cu2+
Chrome (Cr)
Cr3+
Cr6+
Titane (Ti)
Ti2+
Ti3+
Plomb (Pb)
Pb2+
Pb4+
Nom de l'élément
Nom utilisé
Azote
Nitr
Soufre
Sulf
Richesse en O
Préfixe (identique aux HXO)
Suffixe
Très pauvre
Hypo
ite
Pauvre
ite
Riche
ate
Très riche
Per
ate
+I
+II
+III
+IV
+V
+VI
Fer (Fe)
Fe2+
Fe3+
Cuivre (Cu)
Cu+
Cu2+
Chrome (Cr)
Cr3+
Cr6+
Titane (Ti)
Ti2+
Ti3+
Plomb (Pb)
Pb2+
Pb4+
La géométrie repose sur un principe ultra simple : tant les liaisons que les doublets libres sont constitués d'électrons qui cherchent à se repousser au maximum. A partir de là, si on regarde le nombre de doublets ou de liaisons (quelles soient simples, doubles ou tripples) qui entourrent un atome, on va pouvoir définir la géométrie optimale pour cet atome ... et d'atome en atome ... décrire la géométrie moléculaire.
 |
Une approche simplifiée de la géométrie moléculaire |
|
Une approche simplifiée consiste à compter le nombre de voisins qu'à l'atome central et à se référer à une association entre ce nombre de voisin et la géométrie de cet atome.
Définissons un voisin comme une densité électronique présente dans une direction de l'espace. Un voisin cela peut donc être un doublet libre sur un atome, une liaison simple mais aussi une liaison double ou triple.
Il nous suffit alors de les comptabiliser et de se référer au tableau suivant qui donne la meilleure façon d'éloigner au maximum ces voisins.
| La liaison de deux atomes donne nécessairement une molécule linéaire. Dans la molécule suivante, chaque atome a un voisin |
| Lorsqu'un atome fait deux liaisons, il a deux voisins. Géométriquement, pour les éloigner le plus possible, il les place à 180° l'un de l'autre. La molécule est donc toujours linéaire. |
|
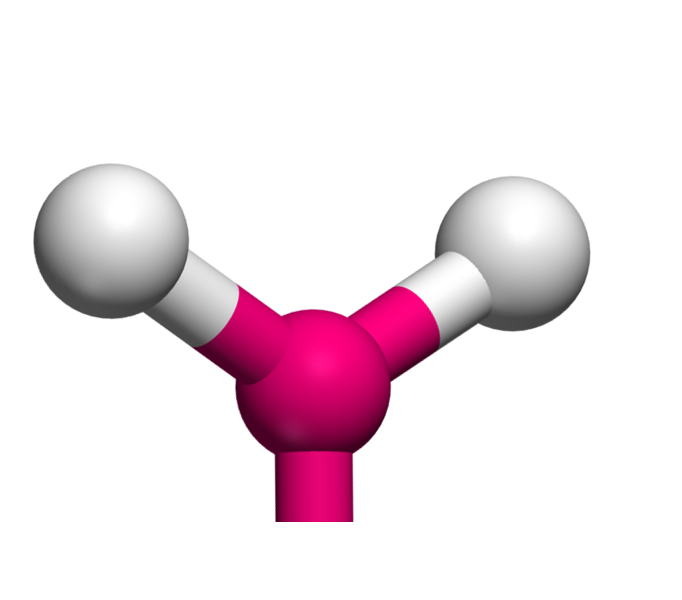
Lorsqu'un atome fait trois liaisons, il a trois voisins. Géométriquement, pour les éloigner le plus possible, il les place à 120° l'un de l'autre. La molécule est donc triangulaire ... et plane.
|
|
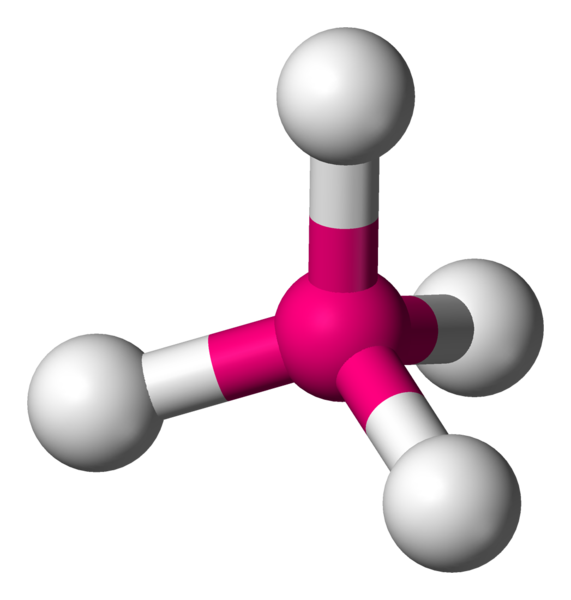
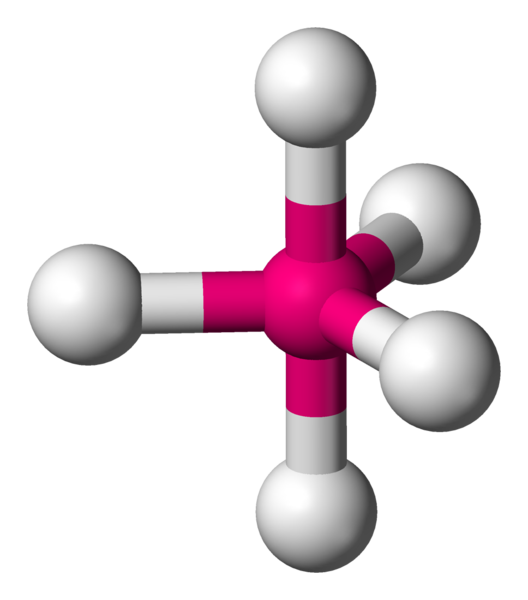
Quand il faut lier 4 voisins, il faut alors utiliser les 3 dimensions de l'espace. Géométriquement, pour les éloigner le plus possible, il faut les éloigner chacun d'un angle de 109,4°. La forme particulière obtenue est appelée tétraèdre.
|
|
Avec 5 voisins, les minimum d'interactions, se réalise en plaçant 3 atomes dans un plan à 120° comme dans la géométrie triangulaire plane. Comme il reste une place au dessus et en dessous du triangle, il y a la place pour fixer de part et d'autre du triangle les deux atomes restants. On appelle cela une bipyramide à base triangulaire.
|
|
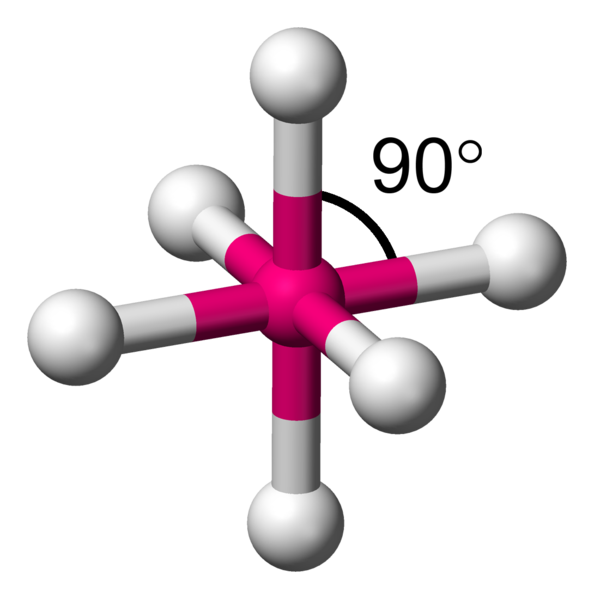
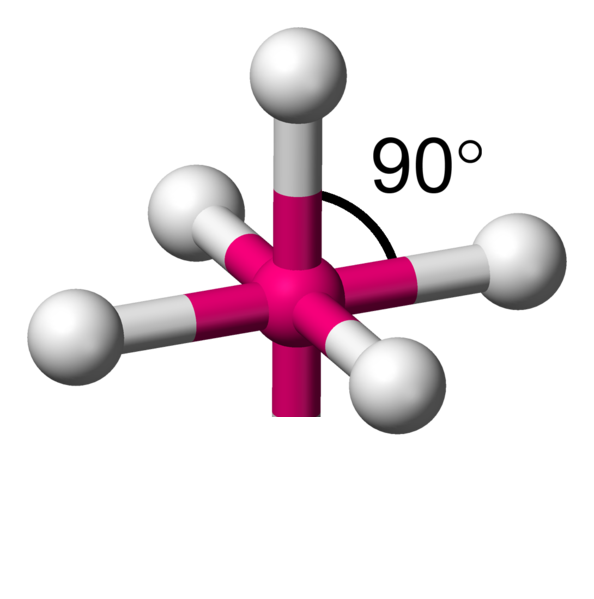
Avec 6 voisins, les minimum d'interactions, se réalise en plaçant 4 atomes dans un plan à 90°.Comme il reste une place au dessus et en dessous du carré formé, il y a la place pour fixer de part et d'autre les deux atomes restants. On appelle cela une bipyramide à base carrée.
|
Ceci nous donne la géométrie de l'atome central qui peut différer de celle de la molécule si il y a des doublets libres sur l'atome.
De plus, comme nous considérons comme un seul et même voisin un doublet libre basé sur l'atome (et donc qui l'encombre plus) ou une liaison dont la densité électronique est déportée plus loin de l'atome, nous devons apporter une correction aux angles. En effet, deux doublets libres se repoussent plus que ce que se repoussent un doublet libre et une liaison. Finalement deux liaisons se repoussent moins.
|
Prenons l'exemple de la molécule d'eau (H2O) :
L'animation de droite montre une molécule d'eau (sans les doublets représentés) avec au départ un angle de 109,4°, puis l'optimisation de l'angle en prenant en compte les répusions. On obtient alors une molécule coudée.
|
 |
La géométrie moléculaire par Gillespie |
|
La méthode de Gillespie prend en compte directement tous les paramètres afin d"obtenir à la fois la géométrie de l'atome central et celle de la molécule. Le revers de la médaille est que les associations sont plus nombreuses.
Pour y arriver, Gillespie va utiliser une notation particulière pour décrire l'entourage de l'atome central :
| AXnEm |
A représente l'atome central X les liaisons (n est le nombre de liaisons simples, doubles ou triples) E les doublets libres (m est le nombre de doublets présents sur l'atome) |
Les changement amenés par Gillespie peuvent être classés de la même manière que ceux de la méthode simplifiée. En réalité cette méthode simplifiée correspondent au premier cas de Gillespie, celui d'un atome central sans doublet.
| La liaison de deux atomes donne nécessairement une molécule linéaire. Dans la molécule suivante, chaque atome a un voisin |
Pour chaque catégorie de molécule possédant un atome central, il y aura d'autres conformation décrites par Gillespie
|
Lorsqu'un atome fait deux liaisons, il a deux voisins. Que ce soit deux atomes (AX2) ou un atome et un doublet (AXE), pour les éloigner le plus possible, il les place à 180° l'un de l'autre. La molécule est donc toujours linéaire. |
|
|
AX2 exemple : MgCl2 |
AXE exemple : CO |
|
AX3 La structure AX3 est exactement identique à la structure à trois voisins précédemment décrite. Il s'agit d'une molécule triangulaire plane. Exemple : AlCl3
|
AX2E La structure AX2E est un dérivé de la structure AX3. Un atome y est remplacé par un doublet libre. Cette modification a un implication sur la géométrie. On a ici des molécules en V. Exemple : SO2
|
AXE2 La structure AXE2 est un dérivé de la structure AX3. Deux atomes y sont remplacés par un doublet libre. Cette modification a un implication sur la géométrie. On a ici des molécules linéaires. Exemple : SeO
|
||
|
AX4 La structure AX4 est exactement identique à la structure à quatres voisins précédemment décrite. Il s'agit d'une molécule tétraèdrique. Exemple : CH4
|
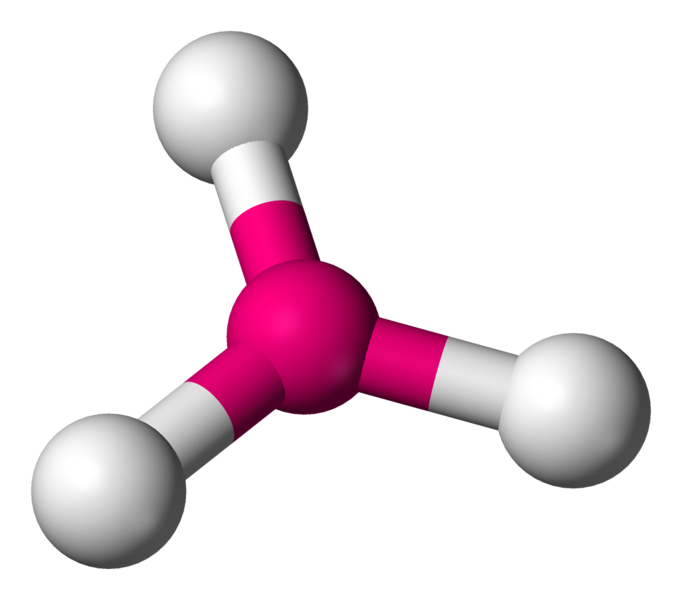
AX3E La structure AX3E est un dérivé de la structure AX4. Un atome y est remplacé par un doublet libre. Cette modification a un implication sur la géométrie. On a ici des molécules en forme de pyramide trigonale. Exemple : NH3
|
AX2E2 La structure AX2E2 est un dérivé de la structure AX4. Deux atomes y sont remplacés par un doublet libre. Cette modification a un implication sur la géométrie. On a ici des molécules en forme de V. Exemple : H2O 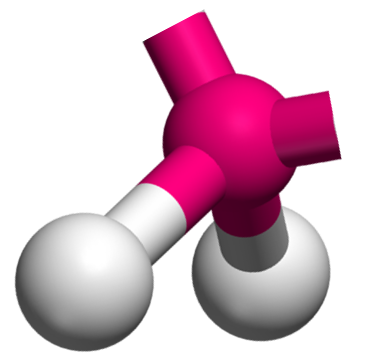 |
AXE3 La structure AXE3 est un dérivé de la structure AX4. Trois atomes y sont remplacés par un doublet libre. Cette modification a un implication sur la géométrie. On a ici des molécules linéaires. Exemple : HCl
|
|||
|
AX5 La structure AX5 est exactement identique à la structure à cinq voisins précédemment décrite. Il s'agit d'une molécule en forme de bipyramide trigonale (à base triangulaire). Exemple : PCl5
|
AX4E La structure AX4E est un dérivé de la structure AX5. Un atome y est remplacé par un doublet libre. Cette modification a un implication sur la géométrie. On a ici des molécules en forme de tétraède irrégulier. Exemple : SF4
|
AX3E2 La structure AX3E2 est un dérivé de la structure AX5. Deux atomes y sont remplacés par un doublet libre. Cette modification a un implication sur la géométrie. On a ici des molécules en forme de T. Exemple : ICl3 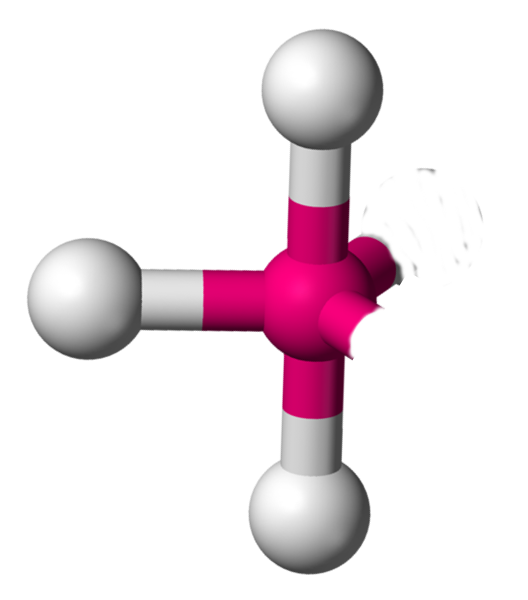 |
AX2E3 La structure AX2E3 est un dérivé de la structure AX5. Trois atomes y sont remplacés par un doublet libre. Cette modification a un implication sur la géométrie. On a ici des molécules linéaires. Exemple : ICl2- 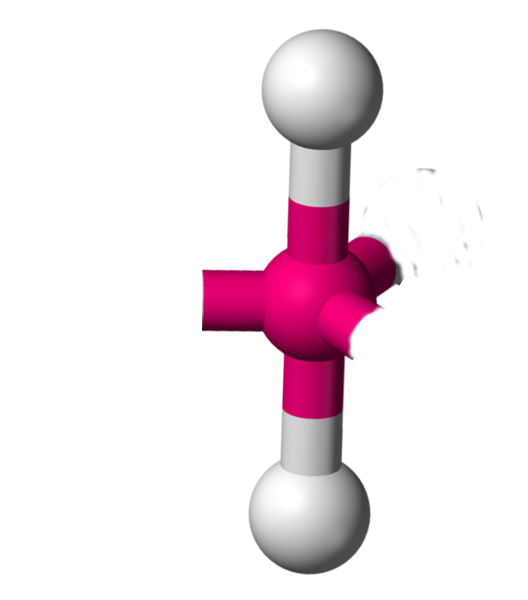 |
|||
|
AX6 La structure AX6 est exactement identique à la structure à quatres voisins précédemment décrite. Il s'agit d'une molécule octaèdrique. Exemple : SF6
|
AX5E La structure AX5E est un dérivé de la structure AX6. Un atome y est remplacé par un doublet libre. Cette modification a un implication sur la géométrie. On a ici des molécules de forme pyramidale. Exemple : BrF5
|
AX4E2 La structure AX4E2 est un dérivé de la structure AX6. Deux atomes y sont remplacés par un doublet libre. Cette modification a un implication sur la géométrie. On a ici des molécules en forme de plan carré. Exemple : ICl4- 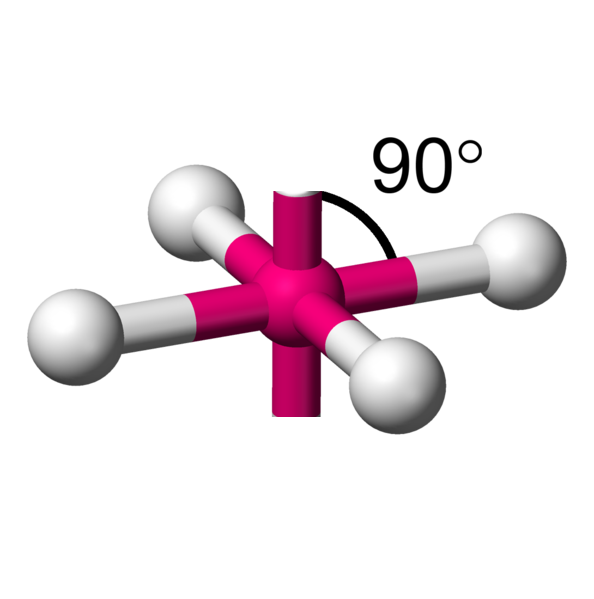 |
||
Un résumé visuel
 |
Un outil pour réaliser les exercices |
|
| {aridoc engine="google" width="500" height="700"}images/Telechargements/Chimie/tableau_gillespie_revu.pdf{/aridoc} |
Cet outil vient unifier ce que nous avons appris. Il va pouvoir vous aider gràce à ses deux voies de lecture :
|
 |
Une implication du type de liaison et de la géométrie : la polarité |
|
La polarité des molécules est une notion très importante car elle va permettre d'expliquer énormément de propriétés physiques et chimiques des matières. Cette notion se base sur deux autres concepts vus précédemment :
- La structure des molécules et plus particulièrement les types de liaisons présentes dans les molécules
- la géométrie des molécules
Une molécule est dite polaire si globalement, elle ressemble à un dipôle. C'est à dire si on peut la résumer à une partie positive, une partie négative séparées par une distance.
|
Dans cette animation, nous considérons une molécule simple, linéaire : celle de HCl. Nous représentons autour de chaque atome leur densité électronique. L'atome de chlore étant plus électronégatif que l'atome d'hydrogène, il attire à lui la densité électronique de l'hydrogène. Il gagne peu à peu un électron alors que peu à peu l'hydrogène le perd. Comme l'électron ne sera pas arraché par le chlore (la différence d'électronégativité n'est pas suffisante), on attribuera au chlore une charge partielle négative et à l'hydrogène une charge partielle positive. On aura entre les deux une liaison covalente normale polarisée. Dans cet exemple, on a donc une chage positive et une charge négative qui sont séparées par une distance (qui est la distance de liaison entre le chlore et l'hydrogène) |
Pour qu'une molécule soit polaire, il faut :
- des charges sur les atomes
- des ions (une différence d'électronégativé supérieure à 1,7)
- des liaisons normales polarisées (différence d'électronégativité entre 0,5 et 1,7)
- une géométrie qui sépare la somme des charges + de la somme de charges -
| Dès qu'une molécule sera ionique (formée d'ions), elle sera forcément polaire car les ions sont chargés et ne sont pas attachés entre eux. Ils interagissent seulement entre eux ; ils sont assez libres les uns par rapport aux autres (la distance entre eux n'est pas fixe ; elle change). |
Par contre, si elle ne possède que des charges partielles, il faudra évaluer sa géométrie afin de savoir si elle est polaire ou non.
En chimie minérale, les molécules sont souvent davantage polarisées et plus petites. Comparons quelques molécules pour comprendre comment savoir si une molécule est polaire ou non polaire.
Nous pourrions continuer ainsi les exemples. Nous remarquons qu'il va être difficile de créer des règles simples. En effet, quelque soit la géométrie, nous trouvons des molécules polaires et non polaires. De plus, en regardant la molécule de CO2 ou de BCl3, nous pourrions avoir tendance à penser que si l'atome central est connecté à plusieurs fois le même atome, la molécule serait non polaire ... mais la molécule de H2O vient contredire cette tendance.
Il va falloir appliquer la définition de la polarité à chaque molécule et voir si la somme des chaeges + et des charges - sont au même endroit ou non.
Nous reparlerons en détail de tout cela dans la partie consacrée à la chimie organique. Nous pouvons cependant déjà dessiner les contours de cette notion de polarité en chimie organique.
| Les molécules en chimie organique sont souvent plus grandes. La grande majorité des liaisons sont des liaisons C-C ou C-H qui ne sont pas polarisées. Seuls quelques atomes (O, N, Cl, Br) peuvent être présents sur les molécules générant une polarisation de certaines liaisons. Dans la grande majorité des cas sonc, ces molécules possèdent une partie polaire et une partie non polaire. On représente souvent alors les molécules avec un rond (ici rouge) pour symboliser la partie polaire et des zig-zags pour symboliser la chaine non-polaire. |  |
Ces propriétés particulières de ces molécues sont à la base de leurs comportements et utilisations particulières tant par l'homme que par la nature. Nous reverrons cela en détail mais voici déjà quelques exemples :
|
Nous savons par exemple que les corps gras qui sont non-polaires (l'huile par exemple) et l'eau (qui est polaire) ne se mélangent pas. Si, à une substance organique, peu ou pas soluble dans l'eau mais dont les molécules possèdent une partie polaire et une partie non polaire, nous ajoutons de l'eau ... Nous aurons deux phases (une phase aqueuse et une phase organique). Nous pouvons représenter les molécules organiques à l'interface entre ces deux phases. Les substances organiques étant très souvent moins denses que l'eau, elles auront tendane à flotter sur l'eau (comme l'huile sur l'eau). A l'interface, les chaines carbonées non-polaires seront donc orientée au dessus, dans la phase organique. Les molécules organiques montreront leur partie polaire à la phase aqueuse qui se trouvera,elle, en dessous. |
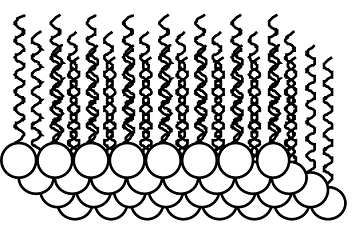 |
|
Cependant, lorsque nous souhaitons laver notre vaisselle par exemple, il nous faut bien faire en sorte que l'eau puisse "laver" et donc emporter la graisse. Nous utilisons pour cela des savons qui ont cette propriété d'avoir une partie polaire (pour se lier avec l'eau) et une partie non-polaire (pour se lier avec la graisse). On appelle ces molécules des tensio-actifs. Dans le cas du savon qui permet de dégraisser, nous allons obtenir des goutte d'huile au centre d'un grand nombre de molécules de savon les entourant. |
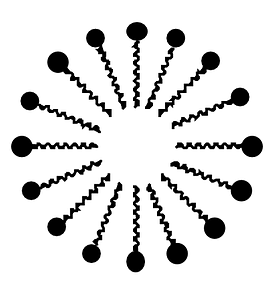 |
| Il est possible d'avoir linverse, c'est le cas des crèmes qui emprisonnent des solutions aqueuses dans un corps gras. Nous avons alors des gouttes d'eau au centre entourées par de nombreuses molécules d'une molécule tensio-active. | 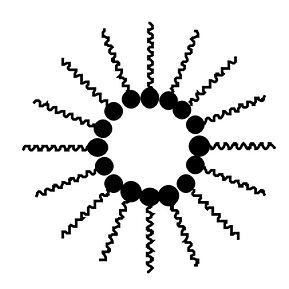 |
|
Finalement, petit lien avec la biologie. Nous savons que nos cellules (qui sont composées d'eau et qui "baignent" dans l'eau) possèdent une bi-couche dite lipidique. Cette bi-couche est constituées par des molécules ayant une partie polaire et non-polaire. Afin de pouvoir interagir avec le milieu extérieur et le milieu intérieur, tous les deux constitués d'eau, il leur est donc nécessaire de se structurer en double couche (bi-couche). A l'intérieur de cette double couche, nous retrouverons les parties non polaires des molécules. |
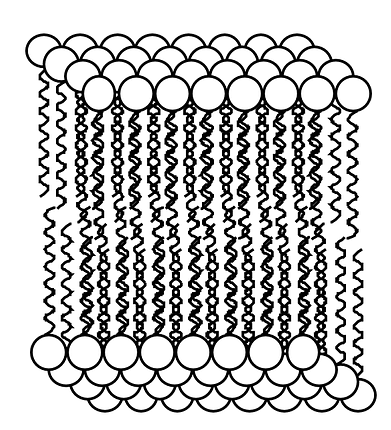 |
Maintenant que nous avons compris ce qu'est une molécule, quelles sont leurs structures, il est important d'aborder un point ... Comment les molécules interagissent-elles ensembles. On ne parle plus de liaisons ici mais d'interactions.
Les interactions sont plus faibles que les liaisons, elles se font et se défont. Elles assurent la cohésion de la matière.
Toutes les interactions entre les molécules sont basées sur le même principe. Sur les molécules, sont présentes ou peuvent apparaitre des charges (+ ou -). L'attraction entre ces charges opposées sera l'interaction. Cette interaction sera d'autant plus forte que la charge est importante ...
Les interactions ions-ions (faussement appelées "liaisons ioniques")
L'interaction la plus évidente est l'interaction entre des ions. Les ions + et les ions - s'attirent. Certaines molécules dont les différences d'électronégativité sont très importantes sont toujours constituées d'ions (même à l'état solide) ; on les appelle des corps ioniques. Il s'agit de l'interaction la plus forte, car les charges sont des charges formelles (des charges entières donc). C'est par exemple le cas de la molécule de chlorure de sodium (NaCl).
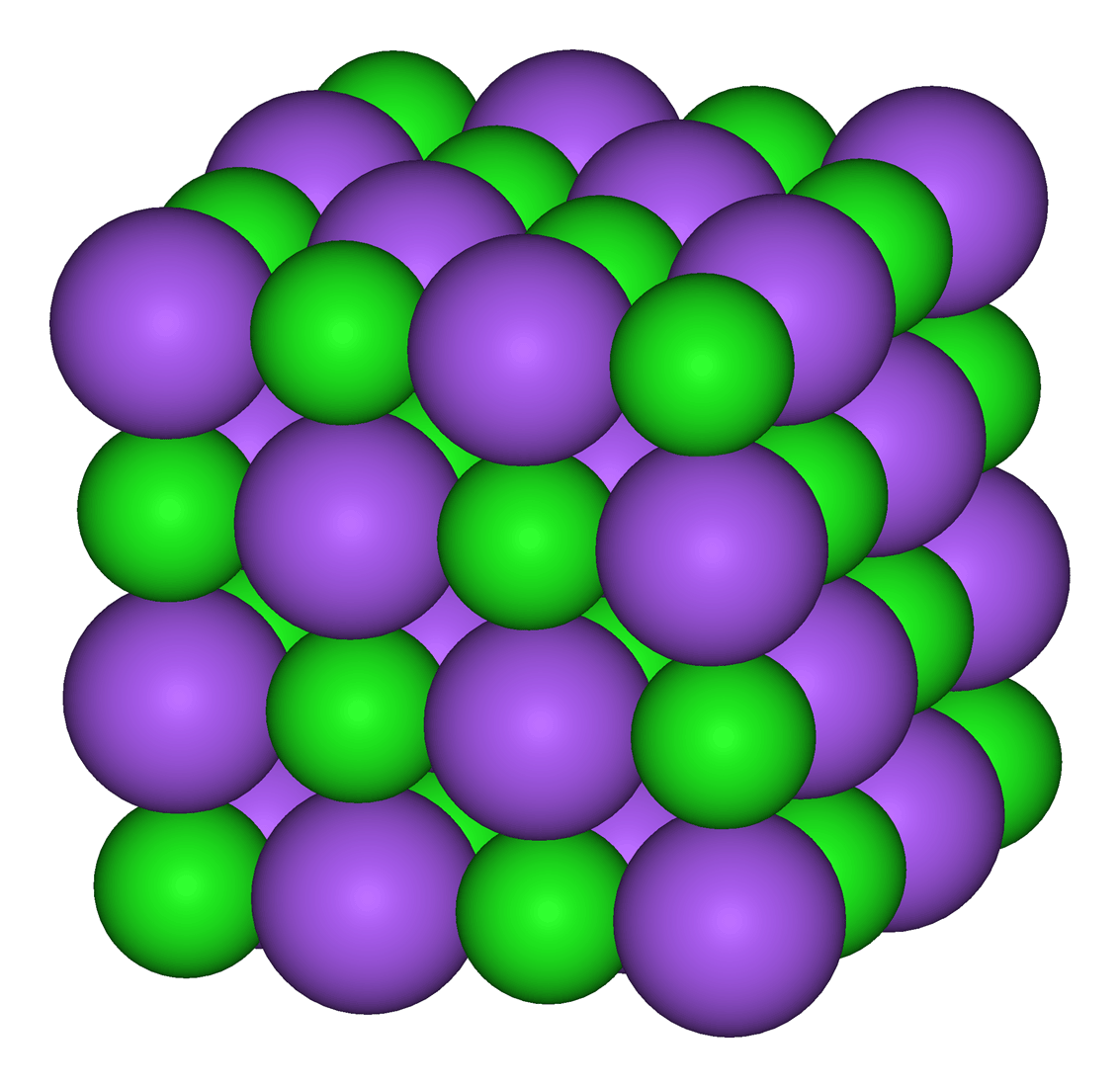 |
||
|
Modélisation d'un cristal de NaCl. En vert, l'ion chlorure et en mauve, l'ion sodium. |
Modélisation des interactions entre deux ions. La distance entre atome change constamment. Ce n'est donc pas une liaison. |
Les ponts hydrogènes (faussement appelés "liaison hydrogène")
Les ponts hydrogènes sont des interactions très importantes mais applicables à peu de molécules. Il faut que les molécules respectent 3 conditions :
- être polaire
- posséder un atome d'hydrogène chargé positivement
- posséder un atome donneur de doublet d'oxygène, d'azote ou de fluor (O, N, F)
Certaine molécules telles que l'eau (H2O), l'ammoniac (NH3) ou encore le fluorure d'hydrogène (HF) sont des représentants classiques de ce type d'interactions. En chimie organique (nous y reviendrons) les amines, les alcools et les acides sont concernés par ces interactions.
L'interaction est formellement une attraction entre l'hydrogène chagé positivement et l'atome possédant un doublet.
| Animation montrant deux molécules d'eau en interaction (pont Hydrogène en tirets jaunes). |
Les forces de Van der Waals (les car il y en a 3 types !)
Il est toujours question d'interactions entre dipôles mais, des interactions de plus en plus faibles.
La plus forte des trois correspond à des molécules polaires qui ne correspondent pas aux trois critères permettant de réaliser des ponts hydrogènes (souvent car l'atome donneur de doublet n'est pas l'oxygène, l'azote ou le fluor). Il s'agit des forces de KEESOM : l'interaction entre deux molécules polaires (donc l'interactions entre deux dipôles permanents).
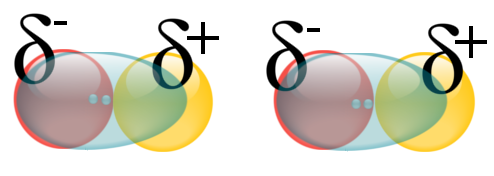 |
||
|
Animation montrant deux molécules d'acide chlorhydrique en interaction. Interactions de Keesom puisque les molécules sont polaires. |
Modélisation de la situation montrant le déplacement des électrons, la déformation du nuage électronique qui en résulte (en bleu) |
A l'opposé des forces de Keesom, les forces de lonfon sont les plus faibles. Elles sont présentes entre deux molécules non polaires ... qui n'ont donc pas de charges permanentes. Ici le dipôle ne sera que momentané. On parlera de dipôle instantané car le déplacement des électrons dans la molécule non polaire provient d'une disymétrie momentanée de la répartition des électrons. Les électrons bougeant vite et de façon désordonnée, les deux électrons de valence peuvent momentanément se retrouver sur l'un ou l'autre atome, créant une disymétrie de la répartition électronique et donc des charges.
Ces forces permettent par exemple d'expliquer la liquéfaction des gaz possédant des molécules non polaires telles que O2, N2 ou CO2. En effet, dans un liquide (nous en reparlerons plus tard), les moléculs interagissent entre elles. Si il n'y avait pas d'interactions entre les molécules, elles ne resteraient pas ensemble, nous aurions alors un gaz.
|
Animation montrant deux molécules de dichlore en interaction. Interactions de London puisque les molécules sont non-polaires. |
Modélisation de la situation montrant le déplacement des électrons, la déformation du nuage électronique qui en résulte (en bleu). |
L'interaction de Debye, reprend en fait un mélange des interactions de London et de Keesom car dans ce cas, une molécule polaire entre en interaction avec une molécule non-polaire. Pour la molécule non-polaire, on parlera de dipôle induit car le déplacement des électrons dans la molécule non polaire est induit par la présence d'un dipôle permanent (ici, la molécule d'acide chlorhydrique).
|
Animation montrant deux molécules, l'une d'acide chlorhydrique et l'autre de dichlore en interaction. Interactions de Debye puisqu'une des molécules est polaire et l'autre non. |
Modélisation de la situation montrant le déplacement des électrons, la déformation du nuage électronique qui en résulte (en bleu) |