|
Les réactions d'oxydation ou de réductions sont omniprésentes dans notre monde. Elles nous sont très utiles (feu, nettoyage, assainissement, protection des aliments) mais elles sont aussi fondamentales pour tout être vivant. La respiration, la photosynthèses mettent en jeu ce type de réactions. Il est donc très important de les comprendre ... |
 |
Quelques définitions |
||||
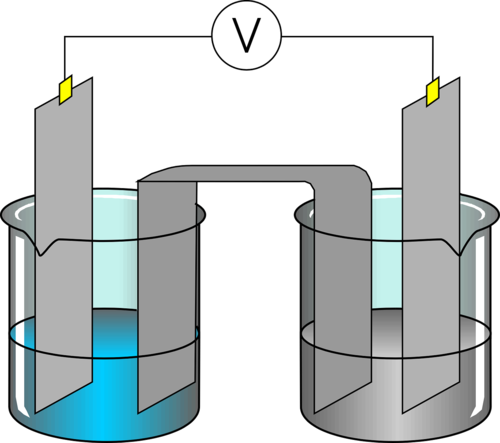
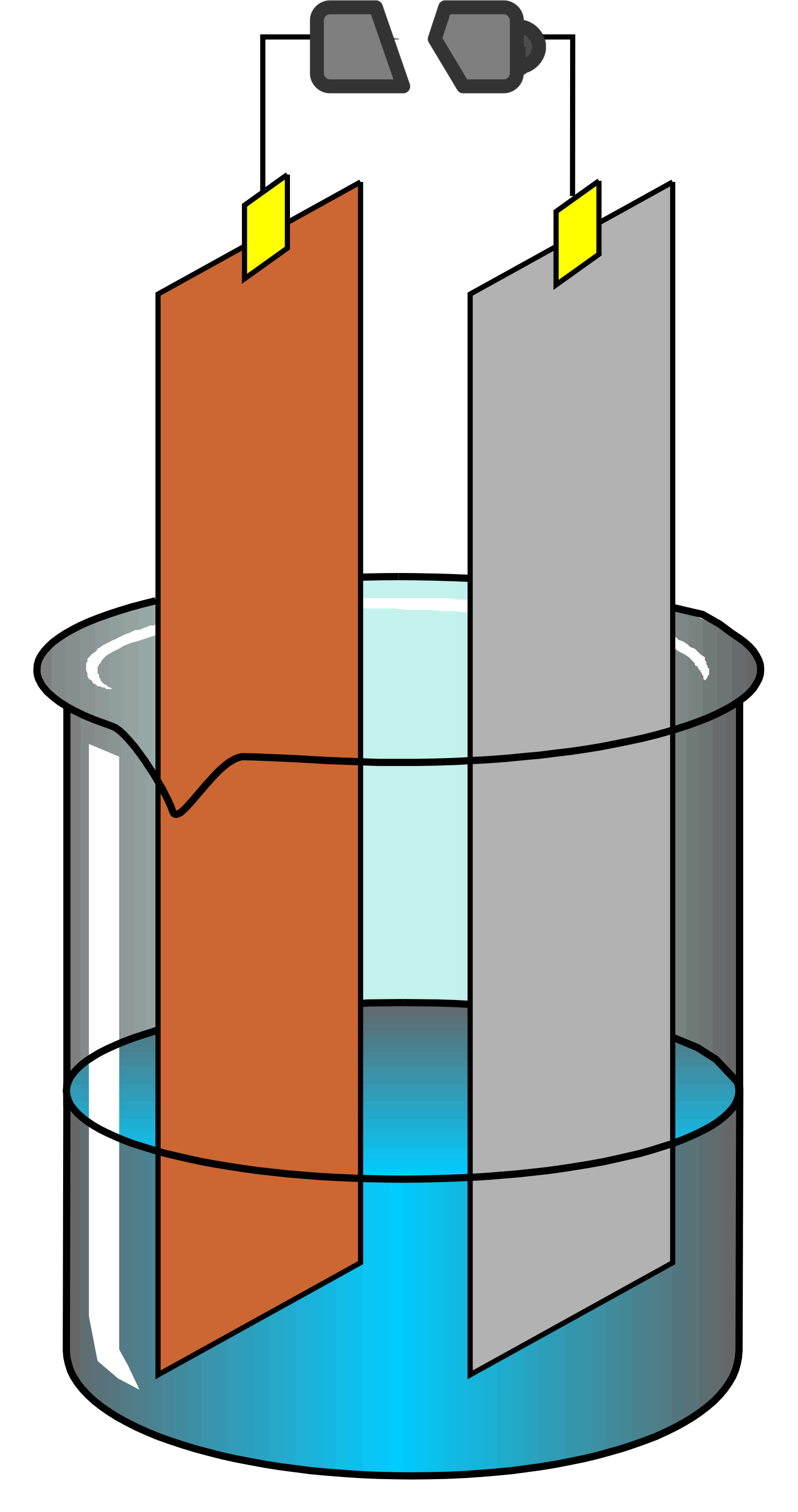
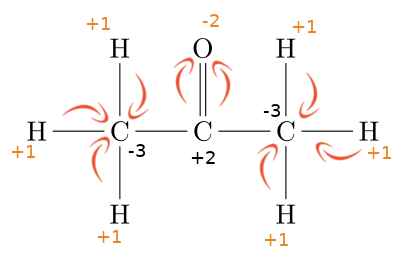
Les réactions d'oxydo-réduction sont définies par un échange d'électrons un par un (et non plus de doublets) entre deux partenaires, un oxydant et un réducteur. Nous pouvons facilement montrer ce transfert d'électrons par l'attaque des métaux par les acides. En effet, un grand nombre de métaux réagissent avec beaucoup d'acides, par exemple ici le zinc avec l'acide chlorhydrique : Dans cet exemple, le zinc (élémentaire) n'a aucune charge. Après réaction avec l'acide, il y a eu formation d'un sel, le chlorure de zinc qui amène le zinc à porter une charge +2. Cette charge marque la perte de deux électrons, ce sera aussi l'étage d'oxydation du zinc dans ZnCl2. L'association de ces deux réactions est appelée oxydo-réduction. Comme il y a échange d'électrons, il y aura une modification des étages d'oxydation de certains éléments. C'est une caractéristique qui permet facilement de déterminer que nous sommes devant une telle réaction. Comme la réaction de réduction est l'inverse de l'oxydation, chaque réaction sera réversible, elles seront donc toutes équilibrées ... Par contre, associer une réaction d'oxydation et une réaction de réduction pourra permettre des réactions complètes, cela dépendra de leur force ! Attention, deux définitions viennent parfois semer le trouble : A nouveau, nous aurons des couples, appelés couples rédox auquels sera associée une valeur qui caractérisera la force du couple (oxydant ou réducteur fort ou faible). Cette valeur est appelée Potentiel standard (noté E°) et exprimé en Volts. Comme il s'agit de transfert d'électrons, nous ne serons pas étonnés de voir la proximité avec la notion d'électricité et le partage d'une unité souvent utilisée en physique.

Au final donc un oxydant se réduit (il passe donc d'une forme oxydée à une forme réduite) et un réducteur s'oxyde (il passe d'une forme réduite à une forme oxydée).
 |
Compléter et équilibrer une rédox est une étape particulière |
||||
La pondération de ces équations est plus complexe que la pondération de toutes les autres équations (qui utilise simplement le calcul mental). Ici de nombreux paramètres doivent etre pris en compte :
- la rédox se passe en deux étapes ; une oxydation et une réduction
- il faut un équilibre de la matière dans chaque partie
- il faut un équilibre des charges dans chaque partie
- il faut tenir compte du milieu (acide, neutre ou basique)
Il nous faut donc une méthode afin d'y arriver rapidement :