|
La modification de la structure électronique sans variation de quantité d'électrons : l'hybridation |
||||
Il arrive que l'existence de certaines molécules ne soit pas compatible avec la structure électronique des atomes telle que nous l'avons décrite jusqu'ici. Il nous faut donc adapter la théorie et ajouter une page en plus à notre modèle atomique. Ces modifications peuvent prendre plusieurs formes mais dans tous les cas, elle répond à une logique de stabilité. L'objectif est d'atteindre, à terme, un état globalement plus stable (moins énergétique - nous en reparlerons) malgré que ces modifications soient souvent source d'augmentation momentanée d'énergie pour l'atome.
Une nouvelle correction doit être apportée au modèle atomique afin de pouvoir expliquer certaines incohérences dont nous allons parler juste après. On appelle cette correction l'hybridation ... Le principe de l'hybridation est de mélanger certaines orbitales, certaines vides, certaines pleines afin de redistribuer les électrons d'une autre façon et soit de désapparier des doublet pour s'offrir d'avantage d'électrons célibataires (et faire plus de liaisons) ou d'apparier des électrons afin d'obtenir un doublet en plus et de s'offrir une orbitale vide permettant à terme d'accepter un doublet et de faire une liaison.
Le désappariement
|
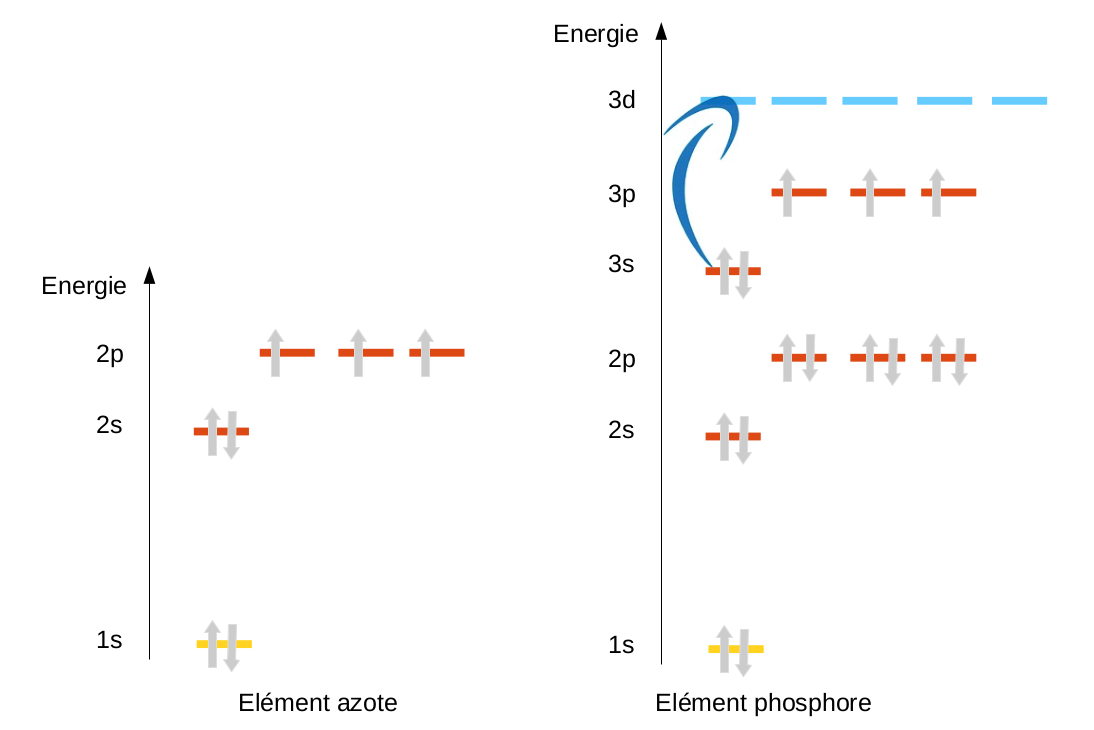
Les plus grandes incohérences proviennent d'un atome en particulier, le carbone. Le carbone possédant 6 électrons, on peut, selon le moyen mnémotechnique proposé lors de la présentation du modèle orbitalaire, définir sa structure électronique : 1s2 2s2 2p2 Cette structure électronique proposée laisse entrevoir pour la dernière couche du carbone un doublet électronique (2s2) et deux électrons célibataires (2p2). En réalité, la seule molécule possédant un carbone de ce type est la molécule de monoxyde de carbone (CO). Cette structure est en totale contradiction même avec la position de l'atome de carbone dans le tableau périodique qui prévoit 4 électrons célibataires. |
 |
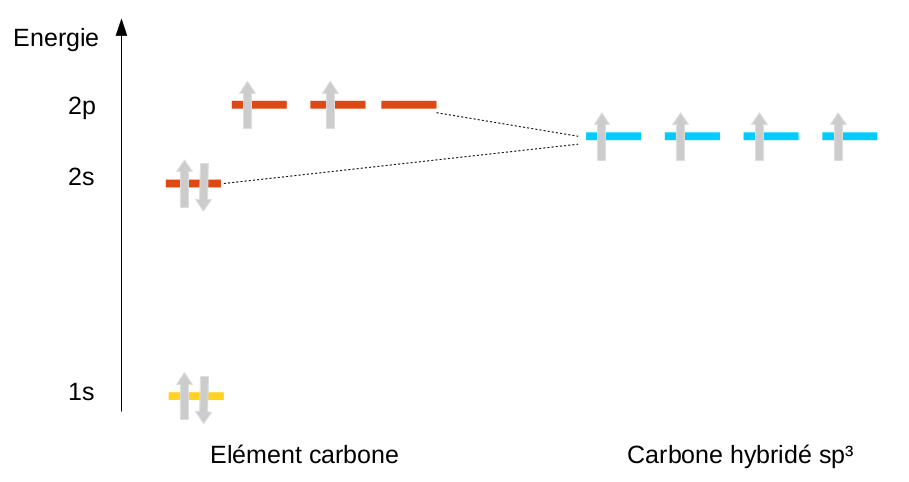
La solution trouvée est d'ajouter la possibilité au carbone, par une hybridation, de mélanger l'orbitale 2s et les 3 orbitales p ... pour en faire 4 nouvelles orbitales appelées sp3 (nom rappelant le type et le nombre d'orbitales mélangées). On peut alors redistribuer les 4 électrons en en plaçant un seul sur chacune des 4 orbitales créées. On arrive à un carbone tétrahédrique :
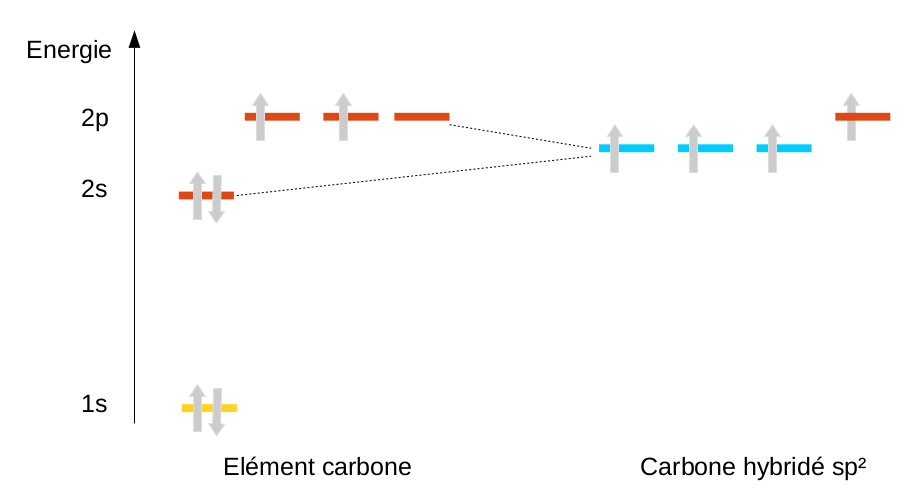
En ne mélangeant qu'une partie des orbitales, on peut aussi expliquer l'existence de doubles (hybridation sp2) et de triples liaisons (hybridation sp) pour le carbone, mais nous en reparlerons en chimie organique.
 |
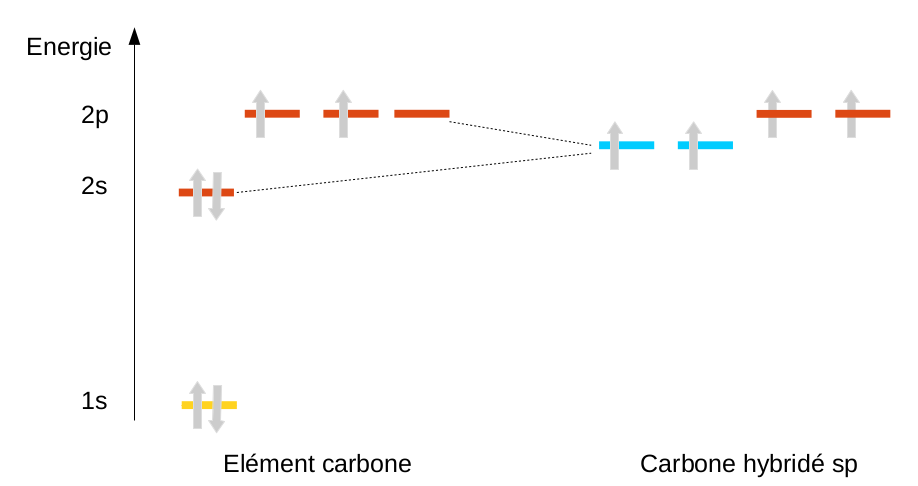 |
L'appariement
Dans certains cas, c'est le contraire dont on a besoin pour justifier l'existence de certaines molécules. Nous le verrons plus tard, quand nous parlerons liaisons et formation de molécules, mais il arrive que nous devions justifier des liaisons difficilement justifiables sans hybridation. C'est par exemple le cas de l'acide nitrique (HNO3).
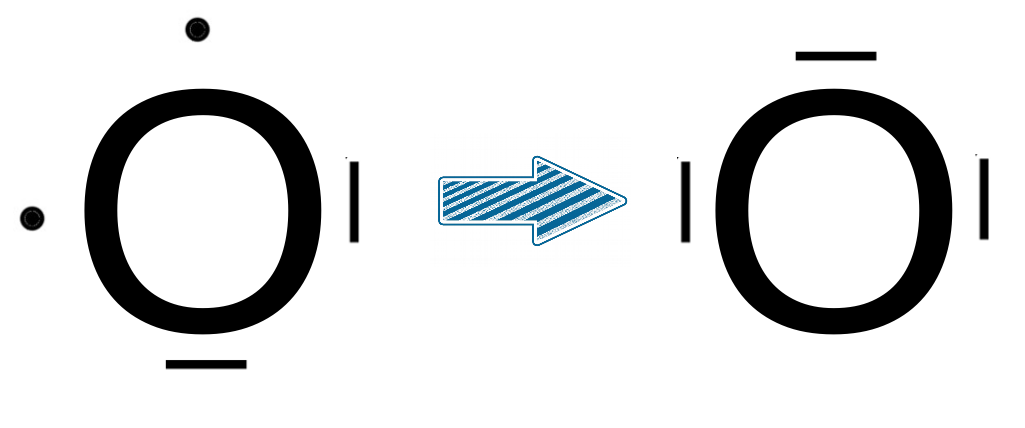 |
C'est par exemple le cas de l'oxygène qui aurait besoin d'une orbitale vide pour accepter un doublet alors que toutes ses orbitales contiennent des électrons (2 doublets et deux électrons célibataires). L'objectif ici sera d'utiliser l'hybridation pour justifier que les deux électrons célibataires vont s'apparier dans la même orbitale afin de créer une orbitale vide. |