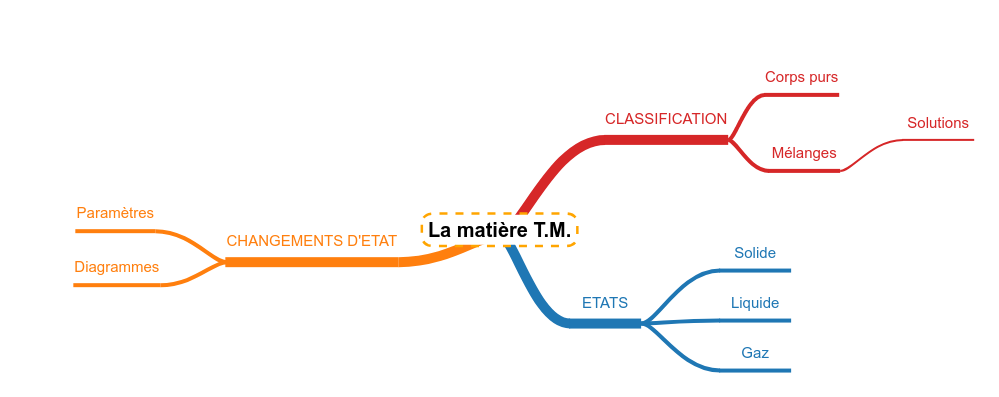
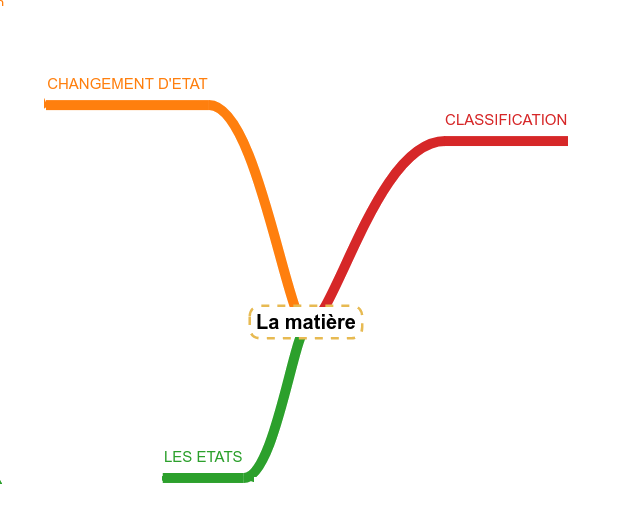
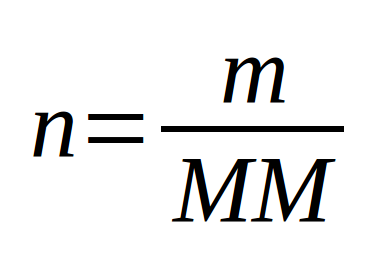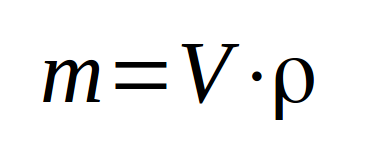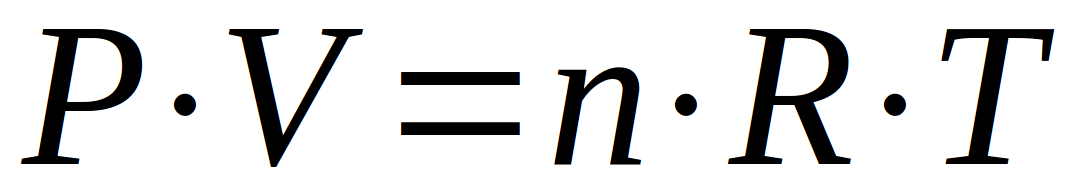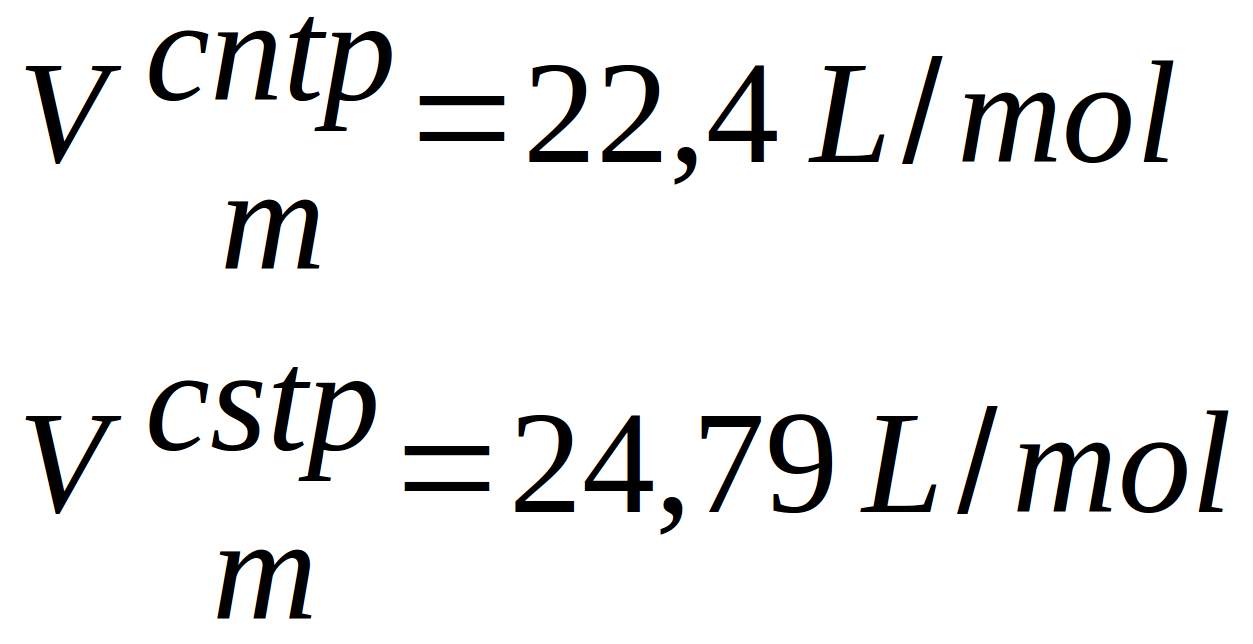Des molécules à la matière
 |
Classer les matières
|
En fonction de sa composition moléculaire, nous pouvons classer la matière en différentes grandes familles. Cette classification amènera des propriétés différentes :
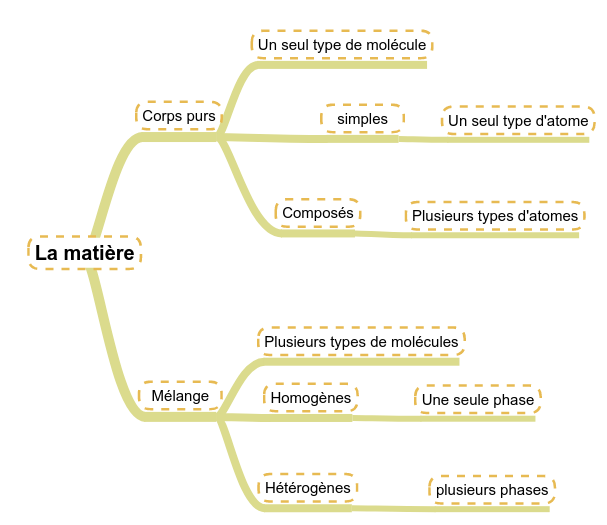
Tout d'abord, nous distinguerons :
- les corps qui ne sont constitués que d'un seul type de molécules : les corps purs
- les corps qui sont constitués de plusieurs molécules : les mélanges.
En regardant chacun de ces types de corps, nous pouvons encore les différencier :
- Dans les corps purs :
- Les corps purs dont les molécules sont composées d'un seul type d'atome : les corps purs simples (O2, N2, ...)
- Les corps purs dont les molécules sont composées de plusieurs types d'atomes : les corps purs composés (CO2, H2O, ...).
- Dans les mélanges :
- Les mélanges dont les différents corps se mélangent : les mélanges homogènes (L'eau et le sel par exemple ...)
- Les mélanges dont les différents corps ne se mélangent pas : les mélanges hétérogènes (L'eau et l'huile ...).
| Mélange homogène |
|
Mélange hétérogène |
|
|
|
|
Lien avec les familles de molécules
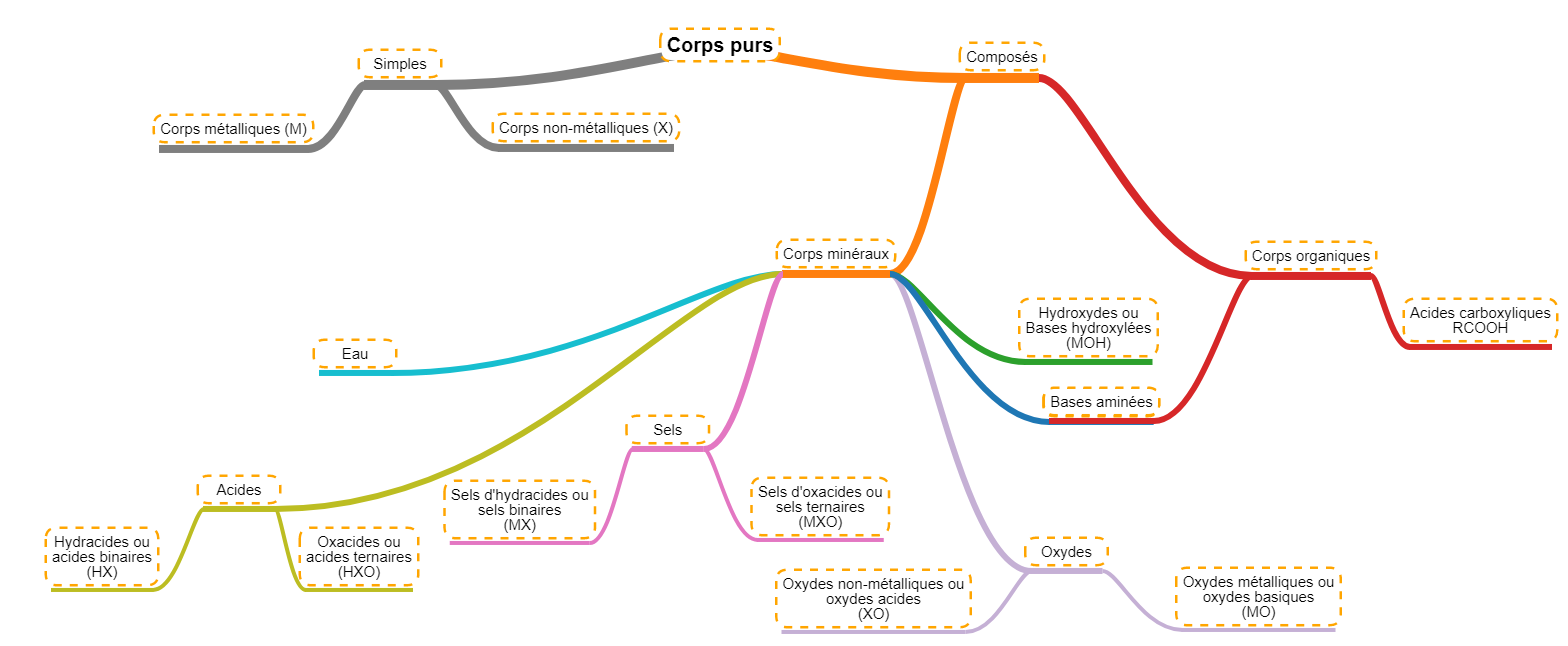
Nous pouvons relier ces grandes familles à ce que nous avons vu avant. En effet, dans les chapitres précédents, nous avons considéré les éléments et les molécules un par un, nous les avons donc considérés comme des corps purs. En replaçant ce que nous avons vu, nous obtenons le diagramme suivant pour les corps purs. Nous ferons aussi directement la distinction entre les corps minéraux (tout ceux dont nous avons parlé jusqu'ici) et les corps organiques qui seront un chapitre à part entière.
 |
Un mélange très important : la solution
|
|
Une solution est un mélange homogène (souvent liquide mais pas nécessairement, on peut avoir des solutions solides ou gazeuses ... ) d'au moins deux corps :
- Un corps étant en plus grande quantité, qui fait le volume de la solution et que l'on appellera le SOLVANT .
- Un corps présent en plus petite quantité, miscible dans le premier, que l'on appelle SOLUTE (soluté). En bleu ci-contre. Il peut-être solide, liquide ... ou même gazeux.
Il peut y avoir plusieurs solutés dans une solution mais il n'y aura qu'un seul solvant.
|
|
|
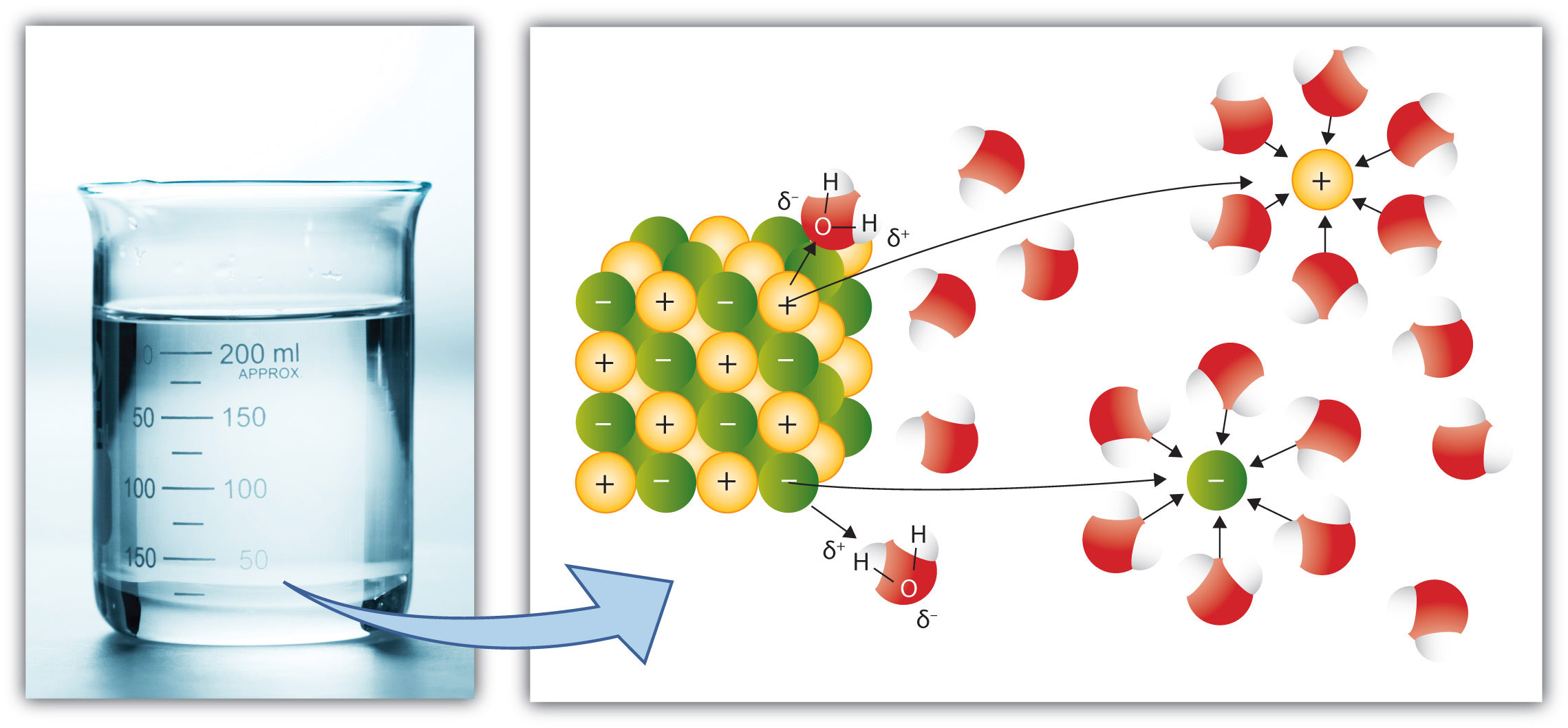
Au niveau moléculaire, une solution est un mélange intime entre les molécules du solvant et les molécules (ou les ions) du soluté. Cela sous entend qu'il y a des interactions moléculaires entre le solvant et le soluté. Une solution ne peut donc se réaliser que si les différentes molécules font des interactions compatibles ... Soit les deux sont non polaires, soit les deux sont polaires, soit les deux possèdent des parties polaires et non polaires.
Le phénomène menant à la formation de la solution s'appelle la SOLVATATION, les molécules du solvant vont entourer les particules (molécules ou ions) de soluté. L'exemple suivant montre la dissolution d'un morceau de sel de cuisine (chlorure de sodium) dans de l'eau. L'eau sépare les ions Na+ et Cl- et les entourre (Solvatation). L'eau de par sa polarité, montrera donc aux ions + son pôle négatif (l'atome d'oxygène) et aux ions -, son pôle positif (ses atomes d'hydrogène).
 |
| By Andy Schmitz (http://2012books.lardbucket.org/) [CC BY 3.0 (https://creativecommons.org/licenses/by/3.0)], via Wikimedia Commons |
 |
Electrolyte ou pas ?
|
Certains solutés vont rester sous forme de molécules dans la solution, d'autres seront sous forme d'ions. Globalement, nous parlerons d'électrolytes, une substance qui conduit le courant car elle est composée d'ions ou de solution moléculaire. Cela va dépendre des propriétés moléculaires du soluté.
Les molécules possédant des liaisons faiblement polarisées resteront sous forme moléculaires
L'exemple de molécules organiques telles que le sucre ou l'alcool est typique. Ces solutés resteront sous forme moléculaire car leurs liaisons sont peu polarisées donc plus fortes, impossible de les casser juste à l'aide d'interactions soluté-solvant.
Les molécules possédant des liaisons plus polarisées s'ioniseront ou se dissocieront, ce sont les électrolytes
- L'ionisation ou la création d'ions
Si les molécules possèdent des liaisons plus polarisées (mais pas ces fameuses "liaisons ioniques"), elles seront partiellement ou totalement sous forme d'ion en solution. Pour ce faire, le solvant devra contribuer à tirer sur les différentes parties de la molécule afin de casser au moins une liaison. On appelera ces composés, des composés IONOGENES (ionogènes = qui peut générer des ions).
Une explication en dessin
Pour ces molécules, il faudra écrire une équation de réaction montrant que la molécule réagit avec le solvant :
- La dissociation ou la séparation des ions
Les molécules possédant une ou plusieurs "liaisons ioniques" sont en réalité formées d'ions ; on les appelle des composés IONOPHORES (Ionophore = qui porte des ions). C'est le cas de nombreux sels, tel que le NaCl dont nous avons présenté la dissolution plus haut.
Pour ces molécules, l'équation ne mentionnera pas le solvant dans les réactifs (A titre informatif, on peut l'indiquer sous la flèche de réaction).
 |
|
Ces ions peuvent venir de substances ionogènes ou ionophores. Dans les électrolytes, nous distinguerons :
- Les électrolytes forts, dont les molécules sont toutes transformées en ions (Tous les ionophores et certains ionogènes)
- Les électrolytes faibles dont certaines molécules sont transformées en ions (les ionogènes qui ne sont pas repris dans les électrolytes forts).
Cette notion d'électrolyte est de loin la plus importante ...
|
 |
La concentration
|
La composition d'une solution est souvent caractérisée par la concentration. La concentration est un concept qui nous permet de connaître la quantité de soluté présente dans une certaine quantité de solution.
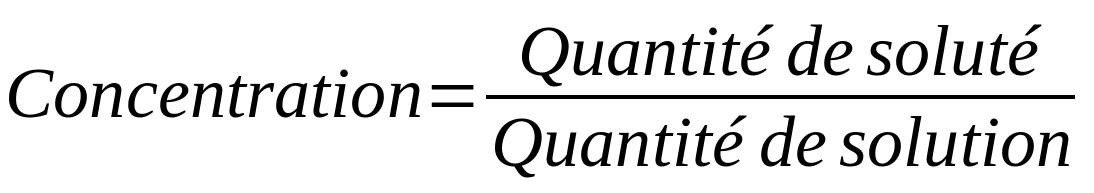
Il existe différents types de concentrations en fonction du paramètre utilisé pour caractériser la quantité (masse, mole, volume) :
- La concentration massique (ou pondérale)
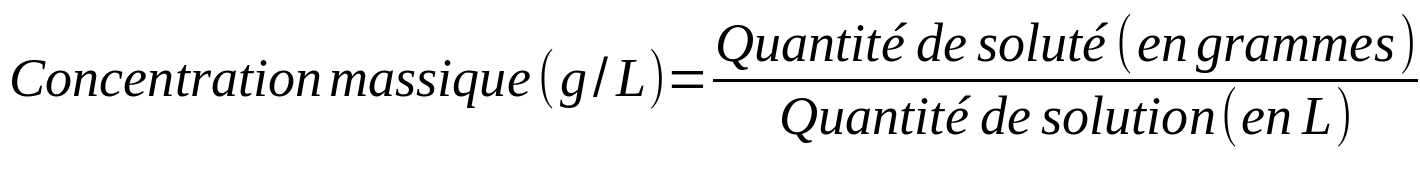
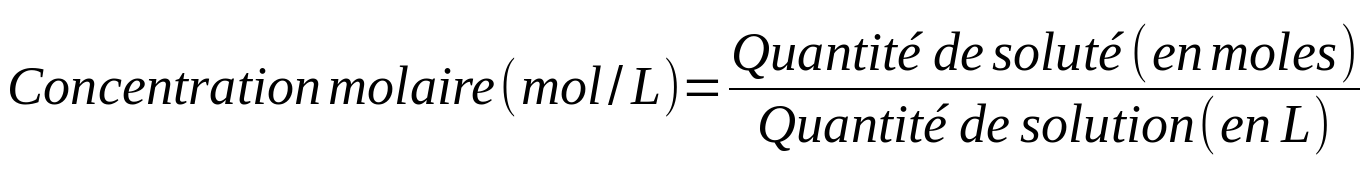
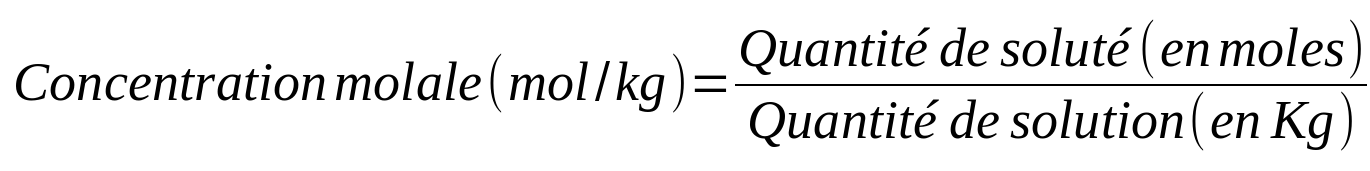
 |
|
Parce que le chimiste utilise souvent la concentration molaire, il a réduit la notation de son unité.
Ainsi, des mol/L peuvent s'écrire M ... que le chimiste lira 'molaire'.
Une solution de concentration égale à 3 mol/L peut donc s'écrire aussi 3M et sera dite 3 molaire.
|
 |
La fraction molaire
|
On peut aussi caractériser une solution par un rapport de moles (moles de soluté par rapport au nombre de moles total), c'est ce que l'on appelle la fraction molaire. C'est similaire à un pourcentage (sans faire x100).
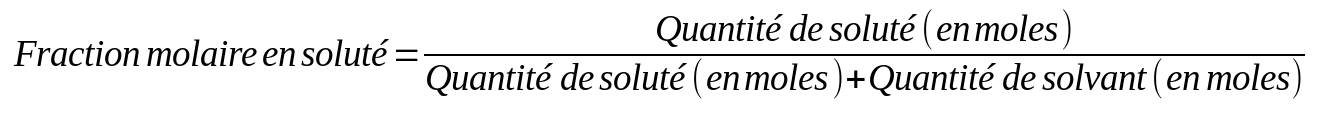
L'association de la masse volumique et de la teneur en soluté comme équivalent de la concentration
Finalement, on peut utiliser la de la solution associée à la teneur en soluté (en % masse/masse)
Les états de la matière
 Cerises plongées dans l'eau avec des bulles d'air attachées à leur surface. Les 3 états de la matière présents. Cerises plongées dans l'eau avec des bulles d'air attachées à leur surface. Les 3 états de la matière présents. |
|
Chaque corps peut se trouver sous différentes formes. Nous appelerons ces formes des états. Les 3 états de la matières sont :
- L'état solide,
- l'état liquide,
- l'état gazeux.
Ces 3 états ont chacuns leurs propriétés qui découlent de leurs structures moléculaires. Nous allons donc parcourir ces 2 états en les caractérisant au mieux tant qualitativement que quantitativement.
|
|
La description des états doit se faire de différentes manières, à la fois au niveau des molécules (microscopiquement) et à la fois au niveau de la matière (macroscopiquement). Il est important de relier les deux points de vus car ce sont les propriétés moléculaires qui confèrent des propriétés particulières aux matières.
|
|
|
 |
Macroscopiquement
|
|
|
On reconnaît l'état solide à sa capacité à avoir une forme propre. Le solide ne coule pas, ne se disperse pas. Une fois posé il garde sa forme.
Il a d'autres propriétés telles que :
- son incompressibilité,
- On ne sait pas compresser un solide, on ne sait pas le compacter d'avantage
- sa masse volumique élevée.
- Un même volume de solide pèsera plus que la grande majorité des liquides. Ils nous apparaitrons donc plus lourds.
|
 |
Microscopiquement |
| |
|
|
|
|
Ces propriétés découlent directement de la structure moléculaire des solides où les particules (atomes ou molécules) sont collées les unes aux autres par de nombreuses interactions fortes. Ces particules sont donc immobiles les unes par rapport aux autres ce qui explique que le solide :
- a une forme puisque les particules se tiennent et sont immobiles.
- n'est pas compressible car il n'y a pas d'espace perdu entre les particules
- a une masse volumique élevée car il y a beaucoup plus de particules dans un même volume.
|
 |
Déterminer la quantité de solide
|
| |
|
|
|
|
|
Un solide, cela se pèse facilement, comme il a une forme, il suffit de le déposer sur une balance. La façon la plus facile de déterminer la quantité de matière est :
- si nous voulons l'exprimer en gramme : de peser le solide.
- si nous voulons l'exprimer : de diviser la masse (obtenue par pesée) par la masse molaire (masse d' de particule).
Uniquement pour un solide pur (Corps pur simple ou corps pur composé) puisque la masse molaire est liée au type de particules (atomes ou molécules).
|
| |
|
La masse volumique est peu utilisée pour les solides car il est plus difficile de mesurer leur volume que de les peser. Cependant, pour de grands solides (une dalle de béton par exemple), il est indispensable de pouvoir transformer le volume en masse. En effet, dans ce cas là, la seule façon d'accéder à la quantité de matière (en masse) est de mesurer le volume de la dalle et de le convertir en masse .... à l'aide de la masse volumique.
La masse volumique est déterminée en pesant un petit volume unitaire (1 dm³ par exemple) de ce solide. Elle représente la masse par unité de volume ... dans cet exemple-ci par dm³, donc par litre.
|
 |
Macroscopiquement
|
On reconnaît l'état liquide à sa capacité à couler et à s'adapter à la surface disponible de son contenant. Le liquide est, avec le gaz, un des deux fluides. On parle de fluide dès qu'une substance sait s'écouler.
Il a d'autres propriétés telles que :
- sa très faible compressibilité,
- sa masse volumique moyenne.
- Un même volume de liquide pèsera plus que les gaz mais moins que les solides. Exception faite du mercure sui est le seul métal liquide dont la densité vaut tout de même 13,6.
|
 |
Microscopiquement |
|
Ces propriétés découlent directement de la structure moléculaire des liquides où les particules (atomes ou molécules) roulent les unes sur les autres. Elles sont retenues par de nombreuses interactions dont la force ne permet pas de figer les particules. L'espacement des particules est plus important que dans le solide ; il y a plus de place "perdue" dans leur agencement.Ces particules sont donc mobiles les unes par rapport aux autres ce qui explique que le liquide :
- coule et adapte sa forme à celle de son contenant.
- est peu compressible car il n'y a que peu d'espace perdu entre les particules
- a une masse volumique moyenne car il y a beaucoup plus de particules dans un même volume que pour le gaz mais un peu moins que dans le solide.
|
|
|
 |
Déterminer la quantité de liquide
|
| |
|
|
|
|
|
Pour déterminer la quantité de matière (en masse) d'un liquide, le plus simple est de mesurer le volume du liquide. A partir de ce volume et connaissant sa masse volumique (ou sa densité), on a accès à la masse de liquide.
La masse volumique est déterminée en pesant un petit volume unitaire (1 dm³ par exemple) de ce liquide. Elle représente la masse par unité de volume ... dans cet exemple-ci par dm³, donc par litre. Attention, il faut décompter la masse du contenant !
|
| |
|
Il est souvent fort utile en chimie de déterminer la quantité de matière (). Que ce soit pour les liquides ou pour les solides dès que l'on a la masse, il est facile de déterminer le nombre de moles à l'aide de la masse molaire.
Uniquement pour un corps pur (Corps pur simple ou corps pur composé) puisque la masse molaire est liée au type de particules (atomes ou molécules).
|
 |
|
Cela n'a aucun sens de parler de concentration pour un liquide pur ...
La concentration n'est applicable qu'aux solutions puisqu'elle défini la quantité de soluté dans une solution. Dans un corps pur, il n'y a pas de soluté ... La concentration n'a donc pas de sens.
On pourra donc calculer le nombre de moles de molécules d'eau qui sont présentes dant un litre d'eau (55,51 mol), par contre, on ne peut absoluement pas dire que l'eau est 55,51M, cela n'a AUCUN SENS !
|
 |
Macroscopiquement
|
On reconnaît l'état gazeux à sa capacité à se disperser et à s'adapter au volume disponible de son contenant. Le gaz est, avec le liquide, un des deux fluides. On parle de fluide dès qu'une substance sait s'écouler.
Il a d'autres propriétés telles que :
- sa très grande compressibilité,
- sa masse volumique très faible.
- Un même volume de gaz pèsera beaucoup moins que le même volume de liquide ou de solide.
|
 |
Microscopiquement |
|
Ces propriétés découlent directement de la structure moléculaire des gaz où les particules (atomes ou molécules) se déplacent vite et sont peu nombreuses. Elles sont peu retenues par des interactions inter-particulaires. L'espacement des particules est très important et les chocs aussi. Il y beaucoup de place "perdue" dans l'agencement particulaire ce qui explique que le gaz :
- diffuse dans tout le contenant et adapte donc son volume à celui de son contenant.
- est très compressible car il y a beucoup d'espace perdu entre les particules
- a une masse volumique faible car il y a très peu de particules dans un même volume.
|
|
|
 |
Déterminer la quantité de gaz
|
| |
|
Le gaz est plus particulier que les autres états car plusieurs paramètres font varier la quantité de particules par unité de volume. Il va donc falloir tenir compte de ces paramètres afin de pouvoir déterminer la quantité de matière (en masse ou en moles) contenue dans un certain volume de gaz.
|
|
|
|
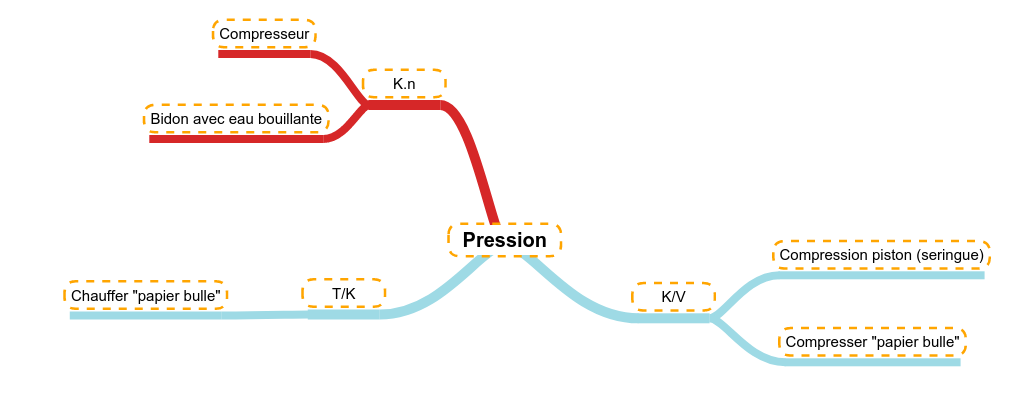
Le volume
Comme le gaz est fort compressible, si on diminue le volume d'une certaine quantité de gaz (la température restant constante), la pression va augmenter.
Exemple 1
Si on enferme un volume d'air dans une seringue, la compression de cet air (diminution du volume) va faire augmenter la pression :
- il est de plus en plus difficile de faire avancer le piston,
- si on lâche le piston, l'air va se détendre (la pression va diminuer) et le volume va réaugmenter.
Exemple 2
Si de l'air est enfermé dans un film plastique étanche (ballon de baudruche ou ici "papier-bulle"), le fait de compresser ce volume d'air va faire augmenter la pression. La pression peut devenir tellement forte que le film plastique casse, c'est l'explosion.
Il y a donc une relation inverse entre le volume et la pression d'un gaz :
V = k/P (1)
|
| |
|
La température
Une faible évolution de la température peut avoir une influence sur les gaz. En augmentant la température, on augmente l'agitation moléculaires (c'est-à-dire la vitesse des molécules). Cette augmentation a comme implication d'augmenter la pression d'un gaz enfermé dans une enceinte close et hermétiquement fermée (ici du "papier-bulle). L'augmentation de pression fini par faire éclater l'enceinte composée d'un simple film plastique.
Il y a donc une relation directe entre la température et la pression d'un gaz :
T = k.P (2)
|
| |
|
La pression
Si dans une enceinte fermée (volume constant) et à température constante, on ajoute de la quantité de matière de gaz, alors cette augmentation aura un impact direct sur la pression à l'intérieur de l'enceinte.
Exemple 1
C'est ce qui se passe quand on branche un compresseur, le moteur pousse de l'air (pris de l'atmosphère) dans un réservoir fermé. Pendant ce travail de remplissage, on remarque que la pression augmente sur le manomètre (dont le rôle est de mesurer et d'indiquer la pression présente à l'intérieur de l'enceinte (réservoir d'air sous pression).
Exemple 2
On peut aussi enfermer de l'eau bouillante dans un bidon en plastique. Le bidon fait office d'enceinte hermétiquement fermée et l'eau bouillante générant au fur et à mesure de la vapeur d'eau (on augmente donc la quantité de gaz). Dans un premier temps, on observe que le bidon gonfle, cela montre qu'il y a augmentation de pression. Ensuite, le volume reste constant et la pression continue à augmenter. Tant que la pression est inférieure à la pression maximale que le bidon peut supporter, le système ne semble pas changer, après, le point faible du bidon lâchera et en fonction des bidons :
- on peut en rester là,
- le bidon peut se déchirer,
- le bouchon peut laisser sortir du gaz ou même s'enlever,
- on peut assister à l'explosion du bidon un peu à la façon des bulles du "papier-bulle"
Il y a donc une relation directe entre la pression et la quantité d'un gaz :
P = k.n (3)
|
|
|
|
Au total, ces 3 relations associées nous donnent une relation unique qui relie ces paramètres que sont la pression, le volume, la quantité (le nombre de moles) et la température d'un gaz. Comme chaque paramètre en influence d'autres, tous ces paramètres sont inter-dépendants.
| (1) |
P = k/V |
|
| (2) |
P = T/k |
| (3) |
P = kn |
Cette relation est appelée "loi des gaz parfaits". Elle répond à un modèle des gaz qui considère :
- qu'il n'y a pas d'interactions entre les particules de gaz (atomes ou molécules)
- que le volume des particules est négligeable par rapport au volume de gaz total.
Aucun gaz ne correspond à ce modèle mais il est souvent utilisé car il est simple et donne une première bonne approximation dans les conditions habituelles de travail (pression et température faibles). Le grand avantage de ce modèle est qu'il ne faut pas tenir compte de la nature du gaz ; contrairement au modèle des "gaz réels" ou des valeurs de constantes doivent être trouvées dans des tables.
Il nous faut encore parler des unités applicables à cette formule, ainsi que des unités de la constante des gaz parfaits (notée R)
- La pression peut prendre plusieurs unités et en fonction de cette unité; celle du volume est fixée
- La quantité de matière est exprimée en
- La température, en Kelvins
| P |
V = |
n |
R |
T |
| bar |
L |
mol |
0,08314 bar L K-1 mol-1 |
K |
| atm |
L |
0,08207 atm L K-1 mol-1 |
| Pa |
m³ |
8,314 Pa m³ K-1 mol-1 |
| mmHg |
L |
62,36 mmHg L K-1 mol-1 |
|
Et le volume molaire dans tout cela ?
|
|
Certains ont pris l"habitude d'utiliser le (ou les) volume(s) molaires ... On peut en effet trouver pour deux conditions particulières (valeurs des paramètres), des volumes occupés par une mole de gaz (volume molaire) :
- à 0°C et 1 atm (conditions normales de température et de pression ou CNTP) : 22,4 L/mole
- à 25°C et 1 bar (conditions standards de température et de pression ou CSTP) : 24,79 L/mole
L'inconvénient de ces valeurs réside dans le fait qu'elles ne concernent que deux conditions particulières alors que la loi des gaz parfaits permet de calculer les paramètres liés à un gaz dans toutes les conditions.
|
Les changements d'état
|
Nous avons décrit les états de la matière. Il est possible de passer de l'un a l'autre en changeant des paramètres. C'est l'étude microscopique qui va nous aider à comprendre comment ces paramètres vont influencer ces changements d'état.
Ci-contre, une vidéo montrant l'effet Mpemba. Cet effet met en avant que l'eau chaude peu geler plus rapidement que de l'eau froide dans certaines conditions.
|
|
|
Découvrir les changements d'états
Avant de comprendre comment cela se passe; il est important de connaître les différents changements d'état. Sur l'image suivante, vous pouvez retrouver un certain nombre de changements d'états courants.
 |
|
Il reste deux transformations sur lesquelles il est important de s'arrêter un peu plus longuement.
Il est en effet possible de transformer un solide en gaz, sans passer par le liquide. Cette transformation s'appelle la sublimation. L'inverse est aussi possible, le gaz se condense en solide, c'est une condensation solide.
Toutes les substances ne le permettent pas ... mais il est assez facile de l'observer avec le dioxyde de carbone ou l'iode. La vidéo ci-contre montre de la neige carbonique (CO2 solide) se sublimant à pression et température ambiante.
|
|
|
Une application des changements d'états : la purification de l'iode par sublimation
L'iode est connue pour se sublimer facilement. A la fin d'une manipulation de synthèse d'iode, sa purification en est simplifiée. Il suffit de faire chauffer l'iode impure synthétisée et de la chauffer légèrement. Des vapeurs mauves caractéristiques se dégagent alors du solide ... Aucun liquide n'est présent.
L'iode se condense alors sur les surfaces froides disponibles. Il suffit d'en récolter les cristaux.
|
A partir du travail de NeilRed - Youtube
|
 |
Les paramètres influençant les changements d'état
|
Si l'on reprend les représentations moléculaires des différents états, on remarque que ce qui les différencie est :
- le mouvement des particules
-
l'espace entre les particules
Pour augmenter le mouvement des particules, il faut leur donner de l'énergie afin d'augmenter leur agitation. C'est possible à l'aide d'un apport en énergie thermique. Le paramètre mesurable sera LA TEMPERATURE. Une augmentation de température favorisera LA FUSION et LA VAPORISATION.
L'espace entre les molécules peut être favorisé par une variation de LA PRESSION. Une augmentation de la pression favorisera LA CONDENSATION et LA SOLIDIFICATION.
Il y a donc systématiquement des couples de valeurs de pression et de température pour lesquels un corps est solide, liquide ou gazeux. Certaines valeurs particulières amènent à des changements d'état (fusion, vaporisation, ...).
Quelques exemples
A 20°C et 1 atmosphère l'eau est liquide
A -4°C et 1 atmophère, l'eau est solide
Mais à 0°C et 1 atmosphère, il y a un équilibre entre l'eau solide et l'eau liquide
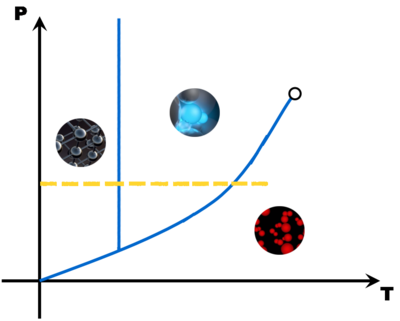
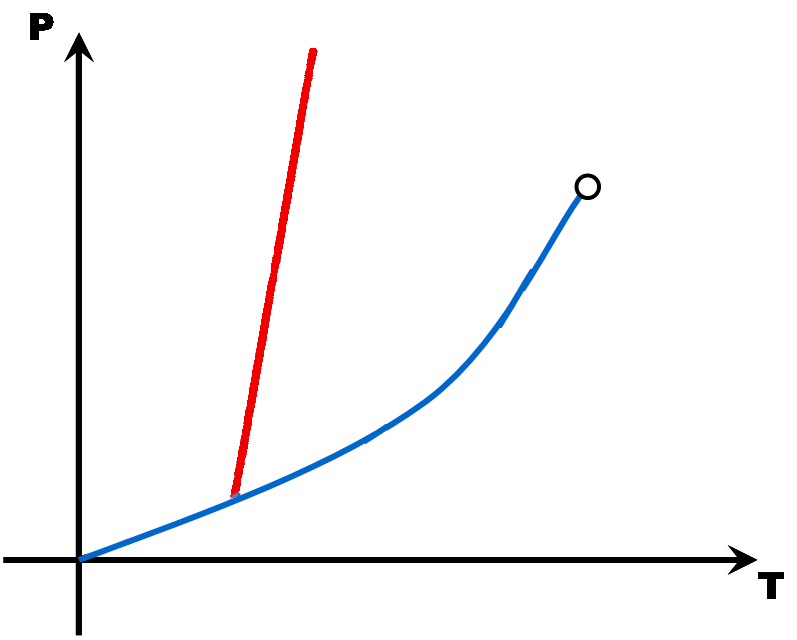
Avec tous ces couples pression - température, on peut construire un diagramme (appelé diagramme d'état) qui montre trois grandes zones, une pour chaque état de la matière. A la limite de deux zones, une droite ou une courbe matérialise l'équilibre entre deux états (le changement d'état).
 |
|
Avec quelques points (Point triple, point critique, point de fusion, point d'ébullition et éventuellement le point de sublimation), il est possible de tracer une esquisse du diagramme d'état d'une matière. Comme en math, il faut juste deux points par droite ou par courbe ...
Ces diagrammes sont utiles pour savoir sous quel état est une matière en fonction des conditions de pression et de température.
|
 |
|
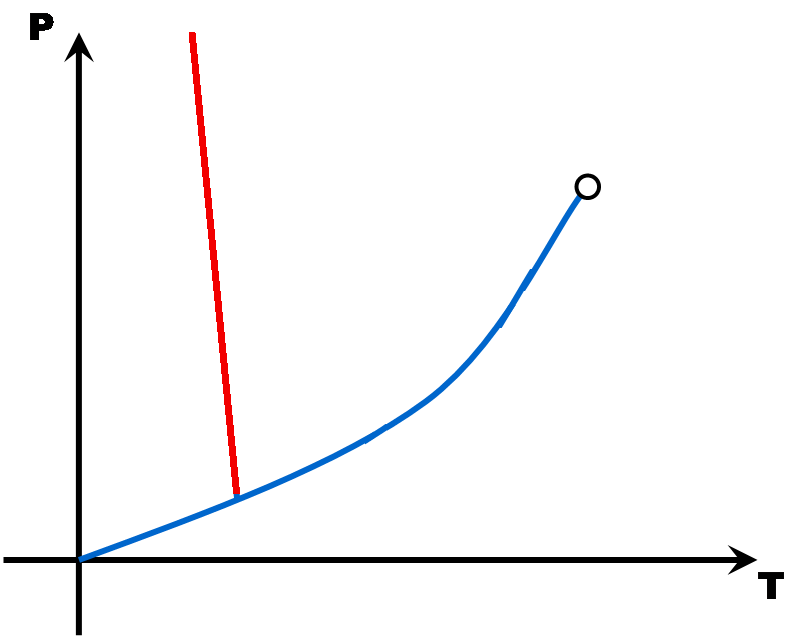
La pente de la droite de fusion (rouge) est toujours positive (droite penchée vers la droite) .. Sauf pour l'eau dont la pente de la droite de fusion est négative (droite penchée vers la gauche).
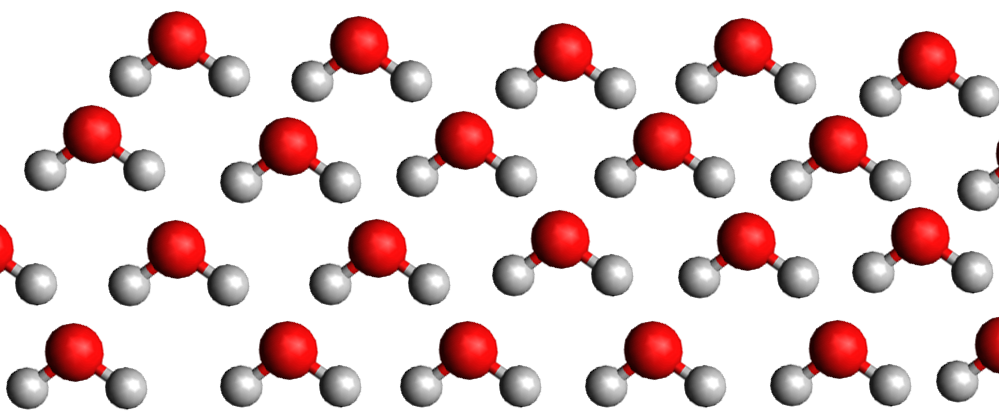
Eau liquide
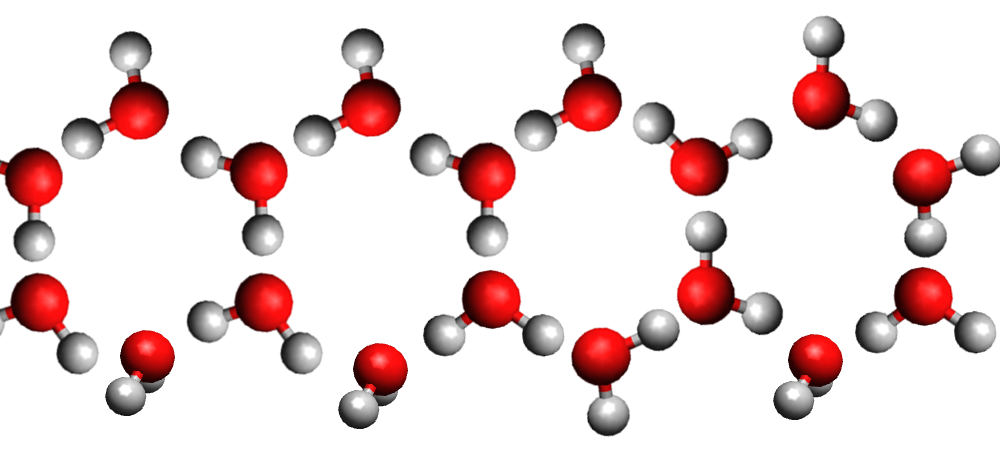
Eau solide
|
|
| |
Pourquoi une telle différence ?
La densité de la glace est plus faible que celle de l'eau liquide car la structure moléculaire du liquide est plus compacte que celle du solide. C'est exceptionnel ... C'est le contraire pour les autres matières.
Ce qui a comme conséquence :
| La glace flotte sur l'eau |
|
| La glace occupe plus de volume que l'eau |
|
|
L'augmentation de pression fait fondre la glace
|
| C'est une propriété intéressante de l'eau, qui a permis l'apparition de la vie ! En effet, la glace flotte, créant une couche isolante au dessus des lacs, protégeant ainsi la vie aquatique. Dans le cas contraire, les lacs seraient transformés en bloc de glace, tuant la vie. |
|
Quand l'eau gèle, elle prend plus de place. Dans un tuyau rempli d'eau par exemple, le gèle amène une forte augmentation de pression dans le tuyau amenant des ruptures de canalisation. |
|
Le fil traverse la glace car la masse des poids suspendus n'est répartie que sur la petite surface du fil. Il en résulte donc une force importante. La glace fond en dessous du fil et l'eau regèle instantanément une fois le fil passé. Le fil peut traverser ainsi le bloc sans le couper !
|
| |
|
|
|
A partir d'une émission des Incroyables Expériences
France 2 - R&G Productions
|






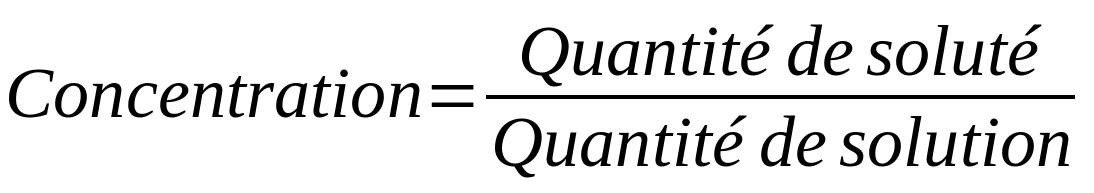
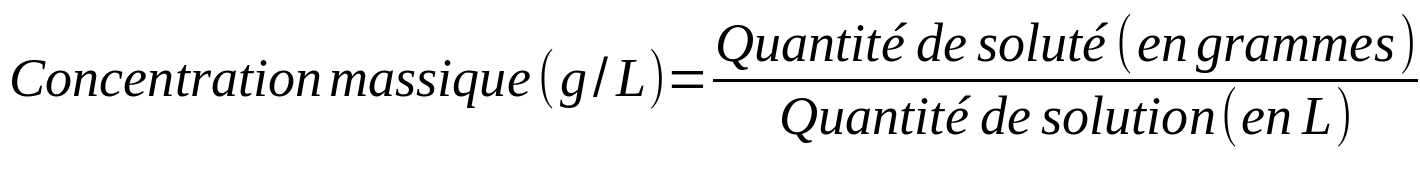
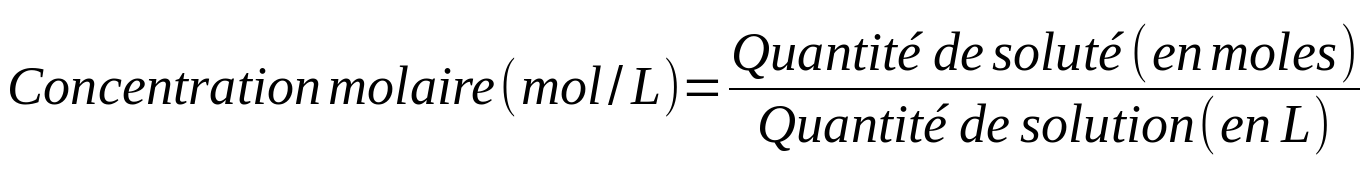
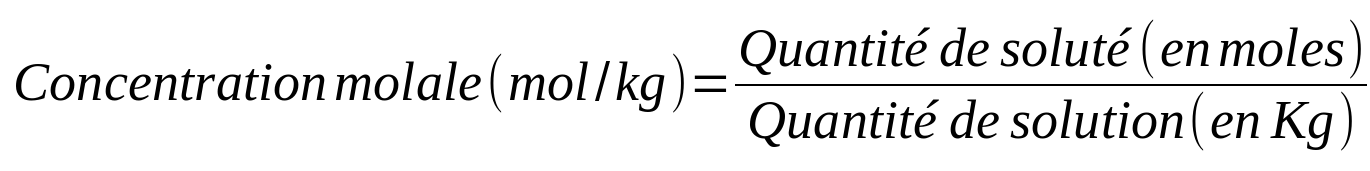


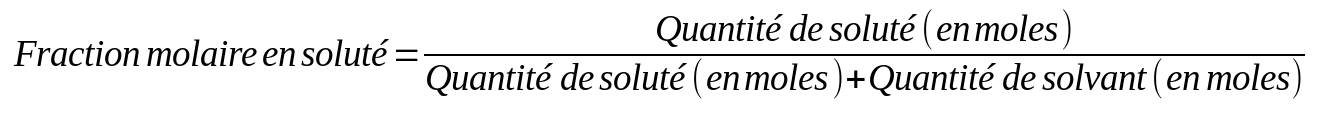





 Cerises plongées dans l'eau avec des bulles d'air attachées à leur surface. Les 3 états de la matière présents.
Cerises plongées dans l'eau avec des bulles d'air attachées à leur surface. Les 3 états de la matière présents.